题目内容
12.设NA代表阿伏加德罗常数的值,下列说法正确的是( )| A. | 7.8gNa2O2中所含有的阴离子数目是0.2NA | |
| B. | 标准状况下,2.24L18O2中含有的中子的数目是NA | |
| C. | 在20℃、1.01×105 Pa时,2.8g C2H4和CO的混合气体含气体分子数是0.1 NA | |
| D. | 标准状况下,a L CH4和a L C6H14中所含分子数均约为$\frac{a{N}_{A}}{22.4}$ |
分析 A、求出过氧化钠的物质的量,然后根据过氧化钠由2个钠离子和1个过氧根离子构成来分析;
B、求出18O2的物质的量,然后根据18O2中含20个中子来分析;
C、C2H4和CO的摩尔质量均为28g/mol;
D、标况下C6H14为液态.
解答 解:A、7.8g过氧化钠的物质的量为0.1mol,而过氧化钠由2个钠离子和1个过氧根离子构成,故0.1mol过氧化钠中含0.1NA个阴离子,故A错误;
B、标况下2.24L18O2的物质的量为0.1mol,而18O2中含20个中子,故0.1mol18O2中含2NA个中子,故B错误;
C、C2H4和CO的摩尔质量均为28g/mol,故2.8g混合物的物质的量为0.1mol,则含0.1NA个分子,故C正确;
D、标况下C6H14为液态,故不能根据气体摩尔体积来计算其物质的量和含有的分子个数,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
3.下列说法正确的是( )
| A. | 煤的干馏、石油分馏、石油裂解都是化学反应 | |
| B. | 煤经过气化、液化等化学变化可得到清洁燃料 | |
| C. | 人造纤维、合成纤维和油脂都是有机高分子化合物 | |
| D. | 棉花、羊毛、蚕丝、麻都由C、H、O元素构成 |
20.下列各组物质中,不是按  (“→”表示一步完成)关系相互转化的是( )
(“→”表示一步完成)关系相互转化的是( )
 (“→”表示一步完成)关系相互转化的是( )
(“→”表示一步完成)关系相互转化的是( )| a | b | c | |
| A | Na | Na2O2 | NaCl |
| B | Cu | CuO | CuCl2 |
| C | HNO3 | NO | NO2 |
| D | SiO2 | H2SiO3 | Na2SiO3 |
| A. | A | B. | B | C. | C | D. | D |
7.下列叙述中正确的是( )
| A. | S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA | |
| B. | 3.4 g NH3中含N-H键数目为0.2NA | |
| C. | 电解精炼铜的过程中,粗铜与电源的负极相连 | |
| D. | CaC2阴阳离子的数目比为1:2 |
17.验证周期表中元素性质的变化规律:
(1)同一周期内从左到右元素的金属性逐渐减弱;
(2)同一主族内从上到下元素的非金属性逐渐减弱.
从下表(Ⅰ)中选择实验方法,从(Ⅱ)中选择相应的实验现象,上下对应地填写在答案的空格中.(不一定全选)
答案:
(1)同一周期内从左到右元素的金属性逐渐减弱;
(2)同一主族内从上到下元素的非金属性逐渐减弱.
从下表(Ⅰ)中选择实验方法,从(Ⅱ)中选择相应的实验现象,上下对应地填写在答案的空格中.(不一定全选)
| 实验方法(Ⅰ) | 实验现象(Ⅱ) |
| A.钠与冷水反应 | a.溶液变红色 |
| B.向NaOH溶液中滴加酚酞 | b.产生白烟 |
| C.点燃H2S | c.反应不十分剧烈,产生的气体能燃烧 |
| D.蘸浓氨水与浓盐酸的两玻璃棒接近 | d.浮于水面,熔成小球,迅速向四处游动 |
| E.NaI溶液中加入溴水 | e.生成白色胶状沉淀,后又溶解 |
| F.镁带与沸水反应 | f.产生大量气泡、气体可以点燃 |
| G.AlCl3溶液中加入NaOH溶液 | g.溶液变棕黄色 |
| H.NaCl溶液中加入溴水 | h.发出耀眼的强光,生成白色物质 |
| I.镁带空气中燃烧 | i.发出淡蓝色火焰 |
| J.NaBr溶液中加入氯水 | j.观察不出什么现象 |
| K.铝片与2mnol/L盐酸反应 | k.溶液变橙色 |
| (1)同周期 | (2)同主族 | |
| Ⅰ | ||
| Ⅱ |
4.X、Y、Z是三种不同的金属,将X、Y分别放入稀盐酸中,只有X表面产生气泡;将Y、Z分别放入硝酸银溶液中,一会儿后,Y表面有银析出,而Z无变化.根据以上实验事实,判断三种金属的活动性顺序为( )
| A. | X>Y>Z | B. | X>Z>Y | C. | Z>X>Y | D. | Y>Z>X |
1.下列溶液,阴离子总浓度最大的是( )
| A. | 0.2 mol•L KNO3 | B. | 0.1 mol•L CuCl2 | ||
| C. | 0.2 mol•L Na2CO3 | D. | 0.2 mol•L(NH4)2SO4 |
11.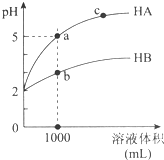 室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如图所示.下列说法正确的是( )
室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如图所示.下列说法正确的是( )
 室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如图所示.下列说法正确的是( )
室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如图所示.下列说法正确的是( )| A. | HA的酸性比HB的酸性弱 | |
| B. | a点溶液的导电性比c点溶液的导电性弱 | |
| C. | 若两溶液无限稀释,则它们的c(H+)相等 | |
| D. | 对a、b两点溶液同时升高温度,则$\frac{c({A}^{-})}{{c(B}^{-})}$增大 |