题目内容
16.室温下,在某NaHSO4溶液中离子的总浓度为0.6mol/L,若向其中加入等体积离子总浓度为0.6mol/L的Ba(OH)2,下列说法不正确的是( )| A. | NaHSO4溶液中c(Na+)=c(OH-)+c(HSO${\;}_{4}^{-}$)+2c(SO${\;}_{4}^{2-}$) | |
| B. | 混合后溶液pH值为13 | |
| C. | 混合溶液中c(Ba2+)+c(Na+)+c(H+)=c(SO${\;}_{4}^{2-}$)+c(OH-) | |
| D. | 加入Ba(OH)2溶液后混合溶液水电离程度比纯水的小 |
分析 A.根据电荷守恒分析;
B.NaHSO4溶液中电离出钠离子、氢离子和硫酸根离子,酸碱中和反应的实质是氢离子和氢氧根离子之间的反应,根据二者量的关系结合公式pH=-lg[H+]来计算;
C.NaHSO4与Ba(OH)2恰好完全反应生成BaSO4沉淀、NaOH和水,根据电荷守恒分析;
D.混合后溶液中溶质主要是NaOH,NaOH会抑制水的电离.
解答 解:A.NaHSO4溶液中完全电离出钠离子、氢离子和硫酸根离子,溶液中电荷守恒为:c(Na+)+c(H+)=c(OH-)+2c(SO42-),故A错误;
B.NaHSO4溶液中电离出钠离子、氢离子和硫酸根离子,NaHSO4溶液中离子的总浓度为0.6mol/L,所以氢离子的浓度为0.2mol/L,离子浓度为0.6mol/L的Ba(OH)2溶液中氢氧根离子的浓度为0.4mol/L,所以等体积混合反应后,氢氧根离子回剩余,氢氧根的浓度为$\frac{0.4V-0.2V}{2V}$=0.1mol/L,氢离子浓度为1×10-13mol/L,所以溶液的pH=13,故B正确;
C.NaHSO4与Ba(OH)2恰好完全反应生成BaSO4沉淀、NaOH和水,溶液中电荷守恒为:2c(Ba2+)+c(Na+)+c(H+)=2c(SO42-)+c(OH-),由于溶液中c(Ba2+)=c(SO42-),所以c(Ba2+)+c(Na+)+c(H+)=c(SO${\;}_{4}^{2-}$)+c(OH-),故C正确;
D.混合后溶液中溶质主要是NaOH,NaOH在水中电离出较多的氢氧根离子会抑制水的电离,所以混合溶液水电离程度比纯水的小,故D正确.
故选A.
点评 本题考查了混合溶液中pH的计算、溶液中守恒关系的应用、影响水的电离的因素等,题目难度中等,注意把握酸碱混合溶液的pH的计算方法,侧重于考查学生的分析能力和计算能力.

 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案| A. | ①②③ | B. | ①②⑥⑦ | C. | ⑤⑥⑦ | D. | ③④⑥ |
| A. | S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA | |
| B. | 3.4 g NH3中含N-H键数目为0.2NA | |
| C. | 电解精炼铜的过程中,粗铜与电源的负极相连 | |
| D. | CaC2阴阳离子的数目比为1:2 |
| A. | X>Y>Z | B. | X>Z>Y | C. | Z>X>Y | D. | Y>Z>X |
(1)调查研究:
①实验盒中记录单上登记的7种溶液是:KMnO4、Na2CO3、CuSO4、NaCl、Ca(OH)2、NaOH和稀盐酸,其中有颜色的是KMnO4和CuSO4 溶液.
②查阅资料:无色有刺激性气味的氯化氢气体溶于水得到盐酸.
(2)提出假设:同学们从5种无色溶液中取出4种,贴上A、B、C、D标签,并且假设这一组溶液是Na2CO3、NaCl、Ca(OH)2和稀盐酸.
(3)实验探究:同学们按以下步骤进行鉴别.
【第一步】取4支试管,分别加入少量的A、B、C、D溶液,然后依次加入少量盐酸,实验现象记录如下:
| 溶液 | A | B | C | D |
| 加入盐酸后的现象 | 无明显变化 | 无明显变化 | 有气泡产生 | 无明显变化 |
【第二步】依据图1装置进行实验,其中夹持固定装置已略去.从长颈漏斗加入盐酸,可以观察到C溶液中有气泡产生,A溶液中有白色沉淀生成,B、D溶液均无明显变化.
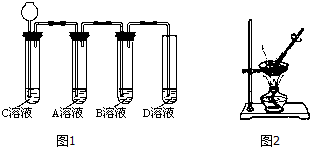
实验解释:A溶液中发生反应的化学方程式为CO2+Ca(OH)2═CaCO3↓+H2O.
C溶液中发生反应的化学方程式为Na2CO3+2HCl=2NaCl+CO2↑+H2O
【第三步】依据图2装置进行2个实验.取少量B溶液倒入蒸发皿,加热,闻到有刺激性气味,停止加热.再取少量D溶液倒入另一蒸发皿,加热,有白色固体析出,停止加热.
实验结论:B是稀盐酸,D是NaCl溶液.
经过上述三步实验,同学们认为第5种无色溶液是NaOH溶液.
(4)实验反思:老师引导同学们讨论了上述实验探究过程.进行了全面反思.
友情提示:鉴别出C溶液后,不需外加试剂,就可以简便地鉴别出A、B溶液.用C溶液简便地鉴别出A、B溶液的方法是:取少量C分别滴入盛有A和B的试管中,A中有白色沉淀产生,A是Ca(OH)2溶液,B中有气泡产生,则可鉴别出B.
| A. | 0.2 mol•L KNO3 | B. | 0.1 mol•L CuCl2 | ||
| C. | 0.2 mol•L Na2CO3 | D. | 0.2 mol•L(NH4)2SO4 |
 已知反应2H2(g)+O2(g)═2H2O(g)的能量变化如图所示,下列说法正确的是( )
已知反应2H2(g)+O2(g)═2H2O(g)的能量变化如图所示,下列说法正确的是( )| A. | 2mol氢气与1mol氧气的总能量为1368kJ | |
| B. | 形成1molH-O键需要吸收463kJ的能量 | |
| C. | 氢气与氧气反应的热化学方程式为2H2+O2═2H2O△H=-484kJ•mol-1 | |
| D. | 1mol氢气与0.5mol氧气反应生成1mol液态水放热大于242kJ |
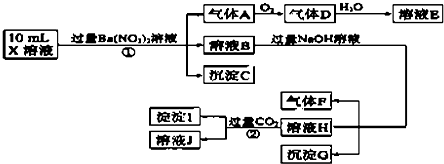
测定A、F、I均为0.1mol,10mL X溶液中n(H+)=0.4mol,沉淀C物质的量小于0.7mol,根据以上信息,下列说法正确的是( )
| A. | 由实验①可知,气体A一定是NO,沉淀C一定是BaSO4,原溶液中肯定含有SO32- | |
| B. | 溶液E和气体F不能发生化学反应 | |
| C. | 由实验 ②可知,沉淀I可能是Al(OH)3和BaCO3 | |
| D. | 原溶液中肯定含有Al3+、NH4+、Fe2+、SO42-、Cl-,不能确定是否含有Fe3+ |
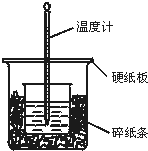 50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: