题目内容
11.用含有Al2O3、SiO2和少量FeO•xFe2O3的铝灰制备Al2(SO4)3•18H2O的工艺流程图如下(部分操作和条件略):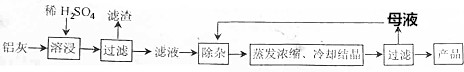
已知:生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
(1)H2SO4溶解Al2O3的离子方程式是Al2O3+6H+=2Al3++3H2O.
(2)检验溶液中还存在Fe3+的方程式是取少量滤液,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+,反之,溶液不变红色,说明滤液中不含Fe3+.
(3)“除杂”环节有如下几个步骤,(Ⅰ)向滤液中加入过量的KMnO4溶液,调节溶液的pH为3;(Ⅱ)加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;(Ⅲ)加入MnSO4至紫红色消失、过滤.
①配平下列离子方程式:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
②调节溶液的pH为3的目的是pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀;
③向Ⅱ中的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是生成黄绿色气体,写出其反应的化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑;
④Ⅲ中加入MnSO4的目的是除去过量的MnO4-.
(4)从多次循环使用后母液中可回收的主要物质是K2SO4(填化学式)
分析 Al2O3、SiO2和少量FeO•xFe2O3$\stackrel{稀硫酸}{→}$$\left\{\begin{array}{l}{滤液:硫酸铝、硫酸铁、硫酸亚铁}\\{滤渣:二氧化硅}\end{array}\right.$$\stackrel{过滤}{→}$Al2(SO4)3、FeSO4、Fe2(SO4)3$\stackrel{调节pH1.5-2.8}{→}$让铁离子沉淀完全,得到Al2(SO4)3溶液,再蒸发浓缩、冷却结晶、过滤、洗涤、干燥可得Al2(SO4)3•18H2O.
(1)Al2O3、FeO•xFe2O3能与硫酸反应,而SiO2不与硫酸反应,硫酸溶解氧化铝生成硫酸铝和水;
(2)三价铁离子遇到硫氰酸根离子会呈现红色,据此检验铁离子;
(3)①MnO4-氧化Fe2+,Mn元素的化合价由+7价降低为+2价,Fe元素的化合价由+2价升高为+3价,结合电子、电荷守恒及原子守恒分析;
②铁离子开始沉淀和沉淀完全的溶液pH为1.5~2.8,铝离子开始沉淀pH为3.4,亚铁离子开始沉淀的溶液pH大于铝离子完全沉淀pH,向滤液中加入过量KMnO4溶液,目的是氧化亚铁离子为三价铁离子,依据图表数据分析可知,所以调节溶液的pH约为3,可以使铁离子全部沉淀,铝离子不沉淀分离;
③向Ⅲ的沉淀中加入浓HCl并加热,二氧化锰和浓盐酸在加热条件下反应生成氯化锰、氯气和水;
④MnO4-可与Mn2+反应生成MnO2,过滤除去,所以可以利用MnSO4的溶液和高锰酸钾溶液反应生成二氧化锰,把过量高锰酸根离子除去.
(4)由元素守恒可知,母液中存在较多的K+、SO42-.
解答 解:(1)Al2O3、FeO•xFe2O3能与硫酸反应,而SiO2不与硫酸反应,步骤Ⅰ过滤得到沉淀的主要成分为:SiO2,硫酸溶解氧化铝生成硫酸铝和水,反应的离子方程式为:Al2O3+6H+=2Al3++3H2O,
故答案为:SiO2;Al2O3+6H+=2Al3++3H2O;
(2)三价铁离子遇到硫氰酸根离子会呈现红色,Fe3++3SCN-?Fe(SCN)3溶液,取少量滤液,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+,反之,溶液不变红色,说明滤液中不含Fe3+,
故答案为:取少量滤液,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+,反之,溶液不变红色,说明滤液中不含Fe3+;
(3)①MnO4-氧化Fe2+,Mn元素的化合价由+7价降低为+2价,Fe元素的化合价由+2价升高为+3价,由电子、电荷守恒及原子守恒可知,反应为MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,
故答案为:5;8H+;5;4H2O;
②铁离子开始沉淀和沉淀完全的溶液pH为1.5~2.8,铝离子开始沉淀pH为3.4,亚铁离子开始沉淀的溶液pH大于铝离子完全沉淀pH,向滤液中加入过量KMnO4溶液,目的是氧化亚铁离子为三价铁离子,依据图表数据分析可知,所以调节溶液的pH约为3,可以使铁离子全部沉淀,铝离子不沉淀分离;
故答案为:pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀;
③向Ⅲ的沉淀中加入浓HCl并加热,二氧化锰和浓盐酸在加热条件下反应生成氯化锰、氯气和水,反应方程式为:MnO2+4HCl(浓$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑,生成的氯气是黄绿色气体,能说明沉淀中存在MnO2,
故答案为:生成黄绿色气体;MnO2+4HCl(浓$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑;
④MnO4-可与Mn2+反应生成MnO2,过滤除去,所以可以利用MnSO4的溶液和高锰酸钾溶液反应生成二氧化锰,把过量高锰酸根离子除去.
故答案为:除去过量的MnO4-;
(4)反应后,溶液中存在较多的K+、SO42-便留在母液中,可回收的主要物质为K2SO4,
故答案为:K2SO4.
点评 本题考查实验制备方案,侧重考查学生对原理及操作的分析评价、对数据的分析运用、物质的分离提纯等,需要学生具备知识的基础,难度中等.

| W | X | Y | |
| Z |
(1)Y在元素周期表的位置是第三周期第ⅥA族,其氢化物的电子式为
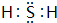 .
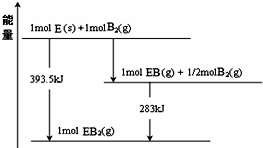
.(2)B元素与Y、Z同主族,且原子半径比二者小.E是形成化合物种类最多的元素,已知一定量的E单质能在B2 (g)中燃烧,其可能的产物及能量关系如图所示,请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式CO2(g)+C(s)=2CO(g)△H=+172.5 kJ•mol -1.
(3)25℃时,NaH2XO2溶液pH>7,向100mL 0.01mol•L-1的H3XO2溶液中,滴加等浓度的NaOH溶液至溶液呈中性,消耗NaOH溶液的体积<(填“>”、“=”或“<”)100mL.
(4)W的最高价氧化物能溶于烧碱溶液,该反应的离子方程式为Al2O3+2OH-═2AlO2-+H2O.现取100mL 1mol•L-1W的氯化物溶液,向其中加入1mol•L-1NaOH溶液产生了3.9g的沉淀,则加入的氢氧化钠溶液体积可能是150或350 mL.
(5)探究同主族元素性质的相似性,是学习化学的重要方法之一.在下表中列出对H2ZO3各种不同化学性质的推测,请根据示例填写下列空格(Z元素符号仍用Z表示)
| 编号 | 性质推测 | 化学方程式 |
| 示例 | 氧化性 | H2ZO3+4HI═Z↓+2I2+3H2O |
| ① | 还原性 | |
| ② | H2ZO3+2NaOH═Na2ZO3+2H2O |
| A. | ${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se是同一种核素 | |
| B. | ${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se互为同位素 | |
| C. | ${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se分别含有44和46个质子 | |
| D. | ${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se都含有34个中子 |
| 选项 | 实验 | 解释或结论 |
| A | 用铂丝蘸取某溶液进行焰色反应,火焰呈黄色 | 该溶液中含Na+、不含K+ |
| B | 向某溶液中滴加KSCN溶液,无明显现象,再滴加少量氯水,溶液变成血红色 | 溶液中含有Fe2+、没有Fe3+ |
| C | 向苯中滴入少量浓溴水、振荡,静置,溶液分层,上层呈橙红色,下层几乎无色 | 苯和溴水发生取代反应,使溴水褪色 |
| D | 在少量无水乙醇中加入金属Na,缓慢生成可以在空气中燃烧的气体 | CH3CH2OH是弱电解质 |
| A. | A | B. | B | C. | C | D. | D |
| A. |  加热NaHCO3固体 | B. |  中和滴定 | ||
| C. |  用苯萃取碘水分离苯层的操作 | D. |  除去氨气中的水蒸气 |
| A. | Na+ | B. | P | C. | Cl | D. | F- |
| A. | 溶液中离子数目增加,导电性增强 | |
| B. | 加水促进醋酸电离,但[H+]、[OH-]均减小 | |
| C. | 加水稀释到1000 mL,溶液的pH=5 | |
| D. | $\frac{[C{H}_{3}CO{O}^{-}]}{[C{H}_{3}COOH]}$增大 |

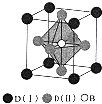 A、B、C、D是周期表中序数依次增大的前四周期元素,A的最高正价与最低负价代数和为零,常温常压下B、C的单质呈气态,A22-、B2、C22+互为等电子体,基态D3+的M层有5个能量和自旋方向均相同的电子,回答下列问题:
A、B、C、D是周期表中序数依次增大的前四周期元素,A的最高正价与最低负价代数和为零,常温常压下B、C的单质呈气态,A22-、B2、C22+互为等电子体,基态D3+的M层有5个能量和自旋方向均相同的电子,回答下列问题: