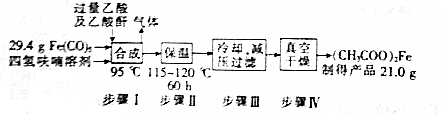
题目内容
19.下列实验现象,解释或结论正确的是( )| 选项 | 实验 | 解释或结论 |
| A | 用铂丝蘸取某溶液进行焰色反应,火焰呈黄色 | 该溶液中含Na+、不含K+ |
| B | 向某溶液中滴加KSCN溶液,无明显现象,再滴加少量氯水,溶液变成血红色 | 溶液中含有Fe2+、没有Fe3+ |
| C | 向苯中滴入少量浓溴水、振荡,静置,溶液分层,上层呈橙红色,下层几乎无色 | 苯和溴水发生取代反应,使溴水褪色 |
| D | 在少量无水乙醇中加入金属Na,缓慢生成可以在空气中燃烧的气体 | CH3CH2OH是弱电解质 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.K元素焰色反应必须透过蓝色钴玻璃观察;
B.能和KSCN溶液反应而生成血红色溶液是铁离子的特征反应,氯气能氧化亚铁离子生成铁离子;
C.甲苯与溴水不发生化学反应;
D.在水溶液或熔融状态下不完全电离出离子的电解质称为弱电解质弱电解质.
解答 解:A.K元素焰色反应必须透过蓝色钴玻璃观察,滤去钠元素黄光的干扰,故A错误;
B.能和KSCN溶液反应而生成血红色溶液是铁离子的特征反应,氯气能氧化亚铁离子生成铁离子,向某溶液中滴加KSCN溶液不变色,说明溶液中不含铁离子,滴加氯水后溶液显红色,说明溶液中亚铁离子被氧化生成铁离子,所以原溶液中一定含Fe2+,故B正确;
C.向甲苯中滴入少量浓溴水,振荡,静置,溶液分层,上层呈橙红色,下层几乎无色,发生了萃取,不发生化学反应,故C错误;
D.钠能与乙醇中的羟基反应生成氢气,与电离无关,故D错误;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及离子检验、取代反应、弱电解质等知识点,明确物质的性质是解本题关键,鉴别物质时要排除干扰因素,易错选项是C,题目难度不大.

练习册系列答案
 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
9.下列各组物质中,化学键类型不同的是( )
| A. | NaCl和K2O | B. | H2O和NH3 | C. | CaF2和NaCl | D. | CCl4和Na2 SO3 |
10.漂白粉在溶液中存在下列平衡体系:ClO-+H2O?HClO+OH-(正反应为吸热反应),以下措施能增强漂白粉的漂白效果的是( )
| A. | 降低温度 | B. | 加入大量的水 | ||
| C. | 加入适量盐酸 | D. | 加入适量烧碱溶液 |
14.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 常温下,22gCO2含碳氧双键数目为2NA | |
| B. | 标准状况下,22.4LBr2中所含分子数为NA | |
| C. | 12.0NaHSO4晶体中含阳离子数目为0.1NA | |
| D. | 7.8gNa2O2与足量 的水反应转移电子数目为0.2NA |
4.(1)已知A和B元素原子的第一至第四电离能如下表所示:
据表中数据,你推断A元素原子最外层有3个电子,已知A和B是同周期元素,可以推出A的金属性<B的金属性(填“>”“<”或“=”).
(2)紫外光的光子所具有的能量约为399kJ•mol-1.根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因紫外光具有的能量比蛋白质分子中重要的化学键C-C、C-N和C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子.组成蛋白质的最简单的氨基酸中的碳原子杂化类型是sp2和sp3.
(3)实验证明:KCl、MgO、CaO三种晶体的结构与NaCl晶体结构相似,则这三种离子晶体(不包括NaCl)熔点从高到低的顺序是:MgO>CaO>KCl.
(4)金属阳离子含有的未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和CrO2中,不适合作录音带磁粉原料的是V2O5.
(5)某配合物的分子结构如图所示,其分子内不含有AC(填序号).
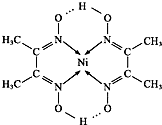
A.离子键 B.极性键 C.金属键 D.配位键E.氢键 F.非极性键
(6)科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中的CO2.若有1mol CH4生成,则反应中有8molσ键生成.
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1 817 | 2 745 | 11 578 |
| B | 738 | 1 451 | 7 733 | 10 540 |
(2)紫外光的光子所具有的能量约为399kJ•mol-1.根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因紫外光具有的能量比蛋白质分子中重要的化学键C-C、C-N和C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子.组成蛋白质的最简单的氨基酸中的碳原子杂化类型是sp2和sp3.
| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |
(4)金属阳离子含有的未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和CrO2中,不适合作录音带磁粉原料的是V2O5.
(5)某配合物的分子结构如图所示,其分子内不含有AC(填序号).

A.离子键 B.极性键 C.金属键 D.配位键E.氢键 F.非极性键
(6)科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中的CO2.若有1mol CH4生成,则反应中有8molσ键生成.
11.用含有Al2O3、SiO2和少量FeO•xFe2O3的铝灰制备Al2(SO4)3•18H2O的工艺流程图如下(部分操作和条件略):
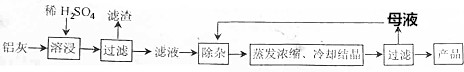
已知:生成氢氧化物沉淀的pH
注:金属离子的起始浓度为0.1mol•L-1.
(1)H2SO4溶解Al2O3的离子方程式是Al2O3+6H+=2Al3++3H2O.
(2)检验溶液中还存在Fe3+的方程式是取少量滤液,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+,反之,溶液不变红色,说明滤液中不含Fe3+.
(3)“除杂”环节有如下几个步骤,(Ⅰ)向滤液中加入过量的KMnO4溶液,调节溶液的pH为3;(Ⅱ)加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;(Ⅲ)加入MnSO4至紫红色消失、过滤.
①配平下列离子方程式:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
②调节溶液的pH为3的目的是pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀;
③向Ⅱ中的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是生成黄绿色气体,写出其反应的化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑;
④Ⅲ中加入MnSO4的目的是除去过量的MnO4-.
(4)从多次循环使用后母液中可回收的主要物质是K2SO4(填化学式)

已知:生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
(1)H2SO4溶解Al2O3的离子方程式是Al2O3+6H+=2Al3++3H2O.
(2)检验溶液中还存在Fe3+的方程式是取少量滤液,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+,反之,溶液不变红色,说明滤液中不含Fe3+.
(3)“除杂”环节有如下几个步骤,(Ⅰ)向滤液中加入过量的KMnO4溶液,调节溶液的pH为3;(Ⅱ)加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;(Ⅲ)加入MnSO4至紫红色消失、过滤.
①配平下列离子方程式:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
②调节溶液的pH为3的目的是pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀;
③向Ⅱ中的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是生成黄绿色气体,写出其反应的化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑;
④Ⅲ中加入MnSO4的目的是除去过量的MnO4-.
(4)从多次循环使用后母液中可回收的主要物质是K2SO4(填化学式)
8.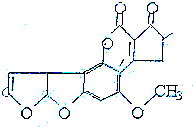 黄曲霉素AFTB(见图)是污染粮食的真菌霉素,人类的特殊基因在黄曲霉素作用下会发生突变,并有引发肝癌的可能性.关于黄曲霉素的说法正确的是( )
黄曲霉素AFTB(见图)是污染粮食的真菌霉素,人类的特殊基因在黄曲霉素作用下会发生突变,并有引发肝癌的可能性.关于黄曲霉素的说法正确的是( )
 黄曲霉素AFTB(见图)是污染粮食的真菌霉素,人类的特殊基因在黄曲霉素作用下会发生突变,并有引发肝癌的可能性.关于黄曲霉素的说法正确的是( )
黄曲霉素AFTB(见图)是污染粮食的真菌霉素,人类的特殊基因在黄曲霉素作用下会发生突变,并有引发肝癌的可能性.关于黄曲霉素的说法正确的是( )| A. | 该化合物的分子式为C16H12O6 | |
| B. | 该化合物水解可生成醇类化合物 | |
| C. | 跟1mol该化合物反应的H2和NaOH的最大值分别是6mol和2mol | |
| D. | 该化合物所有原子可能在同一平面上 |