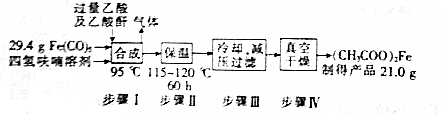
题目内容
16.下列有关实验操作正确的是( )| A. |  加热NaHCO3固体 | B. |  中和滴定 | ||
| C. |  用苯萃取碘水分离苯层的操作 | D. |  除去氨气中的水蒸气 |
分析 A.给固体加热时,试管口应该稍稍向下倾斜;
B.待测液为盐酸,标准液为碱液,需要用碱式滴定管;
C.苯的密度小于水,分层后碘单质的苯溶液在上层;
D.氨气与浓硫酸反应,不能使用浓硫酸干燥,可用碱石灰.
解答 解:A.碳酸氢钠加热分解生成碳酸钠、二氧化碳气体和水,生成的水易时试管炸裂,可以该装置中试管口应该稍稍向下倾斜,故A错误;
B.标准液为碱性,可用碱式滴定管盛放,待测液盐酸放在锥形瓶中,图示操作合理,故B正确;
C.苯的密度小于水,分层后有机层在上层,下层液体从分液漏斗的下层放出,上层液体需要从分液漏斗上口倒出,所以碘的苯溶液应该从上口倒出,图示操作不合理,故C错误;
D.浓硫酸与氨气反应生成硫酸铵,不能用浓硫酸干燥氨气,可用碱石灰作干燥剂,故D错误;
故选B.
点评 本题考查了化学实验基本操作方法的判断,题目难度中等,涉及中和滴定、除杂试剂选用、分液操作、固体加热装置等知识,明确常见化学实验及其操作方法为解答关键,试题培养了学生的化学实验能力.

练习册系列答案
相关题目
6.元素周期表是学习化学的重要工具,它隐含着许多信息和规律.下表所列是五种短周期的原子半径及主要化合价(已知铍的原子半径为0.089nm).
(1)用元素符号标出它们在周期表中对应位置(以下为周期表的一部分).
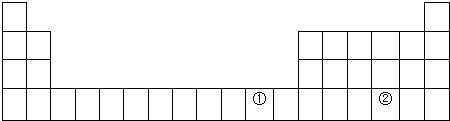
(2)①元素处于元素周期表中四周期IB族;写出该元素(Cu)单质在空气中生锈的方程式2Cu+O2+CO2+H2O=Cu2(OH)2CO3;
(3)A的离子结构示意图为 .B的氧化物溶于氢氧化钠溶液的方程式为Al2O3+2NaOH+3=2NaAlO2+H2O;
.B的氧化物溶于氢氧化钠溶液的方程式为Al2O3+2NaOH+3=2NaAlO2+H2O;
(4)用一个化学方程式证明C、D元素非金属性强弱Cl2+H2S=S↓+2HCl;
(5)元素②与C的最高价含氧酸酸性由强到弱顺序为H2SO4>H2SeO4.(用化学式表示)
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |

(2)①元素处于元素周期表中四周期IB族;写出该元素(Cu)单质在空气中生锈的方程式2Cu+O2+CO2+H2O=Cu2(OH)2CO3;
(3)A的离子结构示意图为
 .B的氧化物溶于氢氧化钠溶液的方程式为Al2O3+2NaOH+3=2NaAlO2+H2O;
.B的氧化物溶于氢氧化钠溶液的方程式为Al2O3+2NaOH+3=2NaAlO2+H2O;(4)用一个化学方程式证明C、D元素非金属性强弱Cl2+H2S=S↓+2HCl;
(5)元素②与C的最高价含氧酸酸性由强到弱顺序为H2SO4>H2SeO4.(用化学式表示)
4.(1)已知A和B元素原子的第一至第四电离能如下表所示:
据表中数据,你推断A元素原子最外层有3个电子,已知A和B是同周期元素,可以推出A的金属性<B的金属性(填“>”“<”或“=”).
(2)紫外光的光子所具有的能量约为399kJ•mol-1.根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因紫外光具有的能量比蛋白质分子中重要的化学键C-C、C-N和C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子.组成蛋白质的最简单的氨基酸中的碳原子杂化类型是sp2和sp3.
(3)实验证明:KCl、MgO、CaO三种晶体的结构与NaCl晶体结构相似,则这三种离子晶体(不包括NaCl)熔点从高到低的顺序是:MgO>CaO>KCl.
(4)金属阳离子含有的未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和CrO2中,不适合作录音带磁粉原料的是V2O5.
(5)某配合物的分子结构如图所示,其分子内不含有AC(填序号).
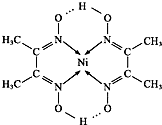
A.离子键 B.极性键 C.金属键 D.配位键E.氢键 F.非极性键
(6)科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中的CO2.若有1mol CH4生成,则反应中有8molσ键生成.
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1 817 | 2 745 | 11 578 |
| B | 738 | 1 451 | 7 733 | 10 540 |
(2)紫外光的光子所具有的能量约为399kJ•mol-1.根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因紫外光具有的能量比蛋白质分子中重要的化学键C-C、C-N和C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子.组成蛋白质的最简单的氨基酸中的碳原子杂化类型是sp2和sp3.
| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |
(4)金属阳离子含有的未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和CrO2中,不适合作录音带磁粉原料的是V2O5.
(5)某配合物的分子结构如图所示,其分子内不含有AC(填序号).

A.离子键 B.极性键 C.金属键 D.配位键E.氢键 F.非极性键
(6)科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中的CO2.若有1mol CH4生成,则反应中有8molσ键生成.
11.用含有Al2O3、SiO2和少量FeO•xFe2O3的铝灰制备Al2(SO4)3•18H2O的工艺流程图如下(部分操作和条件略):
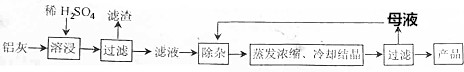
已知:生成氢氧化物沉淀的pH
注:金属离子的起始浓度为0.1mol•L-1.
(1)H2SO4溶解Al2O3的离子方程式是Al2O3+6H+=2Al3++3H2O.
(2)检验溶液中还存在Fe3+的方程式是取少量滤液,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+,反之,溶液不变红色,说明滤液中不含Fe3+.
(3)“除杂”环节有如下几个步骤,(Ⅰ)向滤液中加入过量的KMnO4溶液,调节溶液的pH为3;(Ⅱ)加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;(Ⅲ)加入MnSO4至紫红色消失、过滤.
①配平下列离子方程式:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
②调节溶液的pH为3的目的是pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀;
③向Ⅱ中的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是生成黄绿色气体,写出其反应的化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑;
④Ⅲ中加入MnSO4的目的是除去过量的MnO4-.
(4)从多次循环使用后母液中可回收的主要物质是K2SO4(填化学式)

已知:生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
(1)H2SO4溶解Al2O3的离子方程式是Al2O3+6H+=2Al3++3H2O.
(2)检验溶液中还存在Fe3+的方程式是取少量滤液,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+,反之,溶液不变红色,说明滤液中不含Fe3+.
(3)“除杂”环节有如下几个步骤,(Ⅰ)向滤液中加入过量的KMnO4溶液,调节溶液的pH为3;(Ⅱ)加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;(Ⅲ)加入MnSO4至紫红色消失、过滤.
①配平下列离子方程式:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
②调节溶液的pH为3的目的是pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀;
③向Ⅱ中的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是生成黄绿色气体,写出其反应的化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑;
④Ⅲ中加入MnSO4的目的是除去过量的MnO4-.
(4)从多次循环使用后母液中可回收的主要物质是K2SO4(填化学式)
1.已知反应3O2(g)=2O3(g)的△H<0、△S<0,对此反应叙述正确的是( )
| A. | 该反应在任何情况下均能自发进行 | |
| B. | 该反应在任何情况下均不能自发进行 | |
| C. | 该反应在一定条件下能自发进行 | |
| D. | 条件不足,无法判断 |
8. 黄曲霉素AFTB(见图)是污染粮食的真菌霉素,人类的特殊基因在黄曲霉素作用下会发生突变,并有引发肝癌的可能性.关于黄曲霉素的说法正确的是( )
黄曲霉素AFTB(见图)是污染粮食的真菌霉素,人类的特殊基因在黄曲霉素作用下会发生突变,并有引发肝癌的可能性.关于黄曲霉素的说法正确的是( )
 黄曲霉素AFTB(见图)是污染粮食的真菌霉素,人类的特殊基因在黄曲霉素作用下会发生突变,并有引发肝癌的可能性.关于黄曲霉素的说法正确的是( )
黄曲霉素AFTB(见图)是污染粮食的真菌霉素,人类的特殊基因在黄曲霉素作用下会发生突变,并有引发肝癌的可能性.关于黄曲霉素的说法正确的是( )| A. | 该化合物的分子式为C16H12O6 | |
| B. | 该化合物水解可生成醇类化合物 | |
| C. | 跟1mol该化合物反应的H2和NaOH的最大值分别是6mol和2mol | |
| D. | 该化合物所有原子可能在同一平面上 |
5.某化合物的结构式 (键线式)及球棍模型如图1:该有机分子的核磁共振氢谱图如图2(单位是ppm).下列关于该有机物的叙述正确的是( )
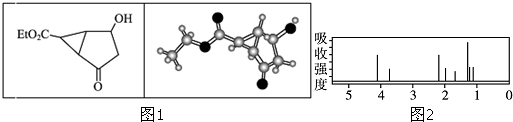

| A. | 该有机物不同化学环境的氢原子有8种 | |
| B. | 该有机物属于芳香族化合物 | |
| C. | 键线式中的Et代表的基团为-CH3 | |
| D. | 利用质谱法不能确定该有机物的相对分子质量 |
15.下列说法正确的是( )
| A. | 1 mL浓氨水加水稀释至l00mL后,溶液中n(OH-)减少 | |
| B. | 室温时,0.1 mol•L-1某一元酸HA在水中有0.1%发生电离,则该溶液的pH=4 | |
| C. | 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| D. | 向Na2CO3溶液通入CO2,可使水解平衡:CO32-+H2O?HCO3-+OH-向正反应方向移动,则溶液pH增大 |