题目内容
3. A、B、C、D是周期表中序数依次增大的前四周期元素,A的最高正价与最低负价代数和为零,常温常压下B、C的单质呈气态,A22-、B2、C22+互为等电子体,基态D3+的M层有5个能量和自旋方向均相同的电子,回答下列问题:
A、B、C、D是周期表中序数依次增大的前四周期元素,A的最高正价与最低负价代数和为零,常温常压下B、C的单质呈气态,A22-、B2、C22+互为等电子体,基态D3+的M层有5个能量和自旋方向均相同的电子,回答下列问题:(1)A、B、C三种元素的第一电离能从大到小的顺序为N>O>C,电负性由大到小的顺序为O>N>C;基态C原子核外未成对电子数为2.
(2)(AB)2中A原子的杂化类型为sp,该分子的空间构型为直线形;[D(AB)6]3-中提供空轨道的微粒是Fe3+.
(3)A的一种含氧酸化学式为A(OH)4,它属于弱(填“强”或“弱”)酸.
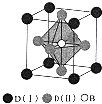
(4)B与D形成间充化合物E,E的一种晶体其晶胞结构如图所示,不同价态D原子数目$\frac{D(Ⅰ)}{D(Ⅱ)}$=1:3;E的化学式为Fe4N.
分析 A、B、C、D、是周期表中序数依次增大的前四周期元素,A的最高正价与最低负价代数和为零,常温常压下B、C的单质呈气态,A22-、B2、C22+互为等电子体,可推知A为碳元素、B为N元素、C为O元素,基态D3+的M层有5个能量和自旋方向均相同的电子,D3+的核外电子排布为1s22s22p63s23p63d5,则D为Fe.
(1)同周期随原子序数增大,元素的电负性增大,元素第一电离能呈增大趋势,氮元素原子2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的;基态C原子核外电子排布式为1s22s22p4;
(2)CN-与氮气分子互为等电子体,(CN)2的结构式为N≡C-C≡N,C原子杂化轨道数目为2;配合物中中心原子或离子含有空轨道,配体含有孤对电子;
(3)A的一种含氧酸化学式为A(OH)4,相当于碳酸,属于弱酸;
(4)根据均摊法计算晶胞中Fe(I)、Fe(II)、N原子数目进行解答.
解答 解:A、B、C、D、是周期表中序数依次增大的前四周期元素,A的最高正价与最低负价代数和为零,常温常压下B、C的单质呈气态,A22-、B2、C22+互为等电子体,可推知A为碳元素、B为N元素、C为O元素,基态D3+的M层有5个能量和自旋方向均相同的电子,D3+的核外电子排布为1s22s22p63s23p63d5,则D为Fe.
(1)同周期随原子序数增大,元素的电负性增大,元素第一电离能呈增大趋势,氮元素原子2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的,故第一电离能N>O>C,电负性O>N>C,基态C原子核外电子排布式为1s22s22p4,4p能级有2个未成对电子,
故答案为:N>O>C;O>N>C;2;
(2)CN-与氮气分子互为等电子体,(CN)2的结构式为N≡C-C≡N,C原子杂化轨道数目为2,采取sp杂化,该分子的空间构型为直线形,[D(AB)6]3-中提供空轨道的微粒是Fe3+,
故答案为:sp;直线形;Fe3+;
(3)A的一种含氧酸化学式为A(OH)4,相当于碳酸,属于弱酸,
故答案为:弱;
(4)晶胞中Fe(I)数目为8×$\frac{1}{8}$=1、Fe(II)数目为6×$\frac{1}{2}$=3、N原子数目为1,D原子数目$\frac{D(Ⅰ)}{D(Ⅱ)}$=1:3,E的化学式为Fe4N,
故答案为:1:3;Fe4N.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电离能、电负性、杂化方式与空间构型、晶胞计算等,注意对基础知识的理解掌握.

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案| A. | N60和N2是同素异形体 | B. | N60中氮原子之间由共价键结合 | ||
| C. | N60高温或撞击后应该生成N2 | D. | N60和14N都是氮的同位素 |
| A. | 常温下,22gCO2含碳氧双键数目为2NA | |
| B. | 标准状况下,22.4LBr2中所含分子数为NA | |
| C. | 12.0NaHSO4晶体中含阳离子数目为0.1NA | |
| D. | 7.8gNa2O2与足量 的水反应转移电子数目为0.2NA |
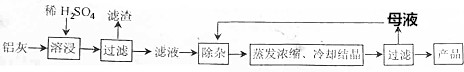
已知:生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
(1)H2SO4溶解Al2O3的离子方程式是Al2O3+6H+=2Al3++3H2O.
(2)检验溶液中还存在Fe3+的方程式是取少量滤液,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+,反之,溶液不变红色,说明滤液中不含Fe3+.
(3)“除杂”环节有如下几个步骤,(Ⅰ)向滤液中加入过量的KMnO4溶液,调节溶液的pH为3;(Ⅱ)加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;(Ⅲ)加入MnSO4至紫红色消失、过滤.
①配平下列离子方程式:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
②调节溶液的pH为3的目的是pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀;
③向Ⅱ中的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是生成黄绿色气体,写出其反应的化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑;
④Ⅲ中加入MnSO4的目的是除去过量的MnO4-.
(4)从多次循环使用后母液中可回收的主要物质是K2SO4(填化学式)
| A. | 低QkJ | B. | 低2QkJ | C. | 高QkJ | D. | 高2QkJ |
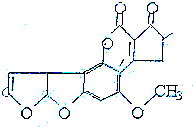 黄曲霉素AFTB(见图)是污染粮食的真菌霉素,人类的特殊基因在黄曲霉素作用下会发生突变,并有引发肝癌的可能性.关于黄曲霉素的说法正确的是( )
黄曲霉素AFTB(见图)是污染粮食的真菌霉素,人类的特殊基因在黄曲霉素作用下会发生突变,并有引发肝癌的可能性.关于黄曲霉素的说法正确的是( )| A. | 该化合物的分子式为C16H12O6 | |
| B. | 该化合物水解可生成醇类化合物 | |
| C. | 跟1mol该化合物反应的H2和NaOH的最大值分别是6mol和2mol | |
| D. | 该化合物所有原子可能在同一平面上 |
| A. | 3-氯戊烷的分子式为C6H9Cl3 | B. | 3-氯戊烷属于烷烃 | ||
| C. | 3-氯戊烷的一溴代物共有3种 | D. | 3-氯戊烷的同分异构体共有6种 |