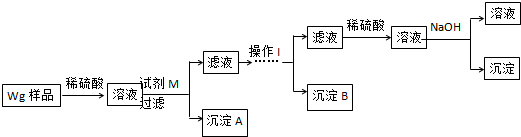
题目内容
20.下列粒子半径最小的是( )| A. | Na+ | B. | P | C. | Cl | D. | F- |
分析 电子层越多,原子半径越大,具有相同排布的离子原子序数大的离子半径小.
解答 解:由电子层越多,原子半径越大,具有相同排布的离子原子序数大的离子半径小可知,微粒半径为P>Cl>F->Na+,则微粒半径最小的为Na+,
故选A.
点评 本题考查微粒半径的比较,为高频考点,把握元素的位置、元素周期律为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
10.漂白粉在溶液中存在下列平衡体系:ClO-+H2O?HClO+OH-(正反应为吸热反应),以下措施能增强漂白粉的漂白效果的是( )
| A. | 降低温度 | B. | 加入大量的水 | ||
| C. | 加入适量盐酸 | D. | 加入适量烧碱溶液 |
11.用含有Al2O3、SiO2和少量FeO•xFe2O3的铝灰制备Al2(SO4)3•18H2O的工艺流程图如下(部分操作和条件略):
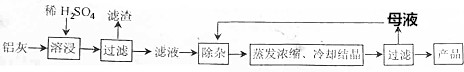
已知:生成氢氧化物沉淀的pH
注:金属离子的起始浓度为0.1mol•L-1.
(1)H2SO4溶解Al2O3的离子方程式是Al2O3+6H+=2Al3++3H2O.
(2)检验溶液中还存在Fe3+的方程式是取少量滤液,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+,反之,溶液不变红色,说明滤液中不含Fe3+.
(3)“除杂”环节有如下几个步骤,(Ⅰ)向滤液中加入过量的KMnO4溶液,调节溶液的pH为3;(Ⅱ)加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;(Ⅲ)加入MnSO4至紫红色消失、过滤.
①配平下列离子方程式:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
②调节溶液的pH为3的目的是pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀;
③向Ⅱ中的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是生成黄绿色气体,写出其反应的化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑;
④Ⅲ中加入MnSO4的目的是除去过量的MnO4-.
(4)从多次循环使用后母液中可回收的主要物质是K2SO4(填化学式)

已知:生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
(1)H2SO4溶解Al2O3的离子方程式是Al2O3+6H+=2Al3++3H2O.
(2)检验溶液中还存在Fe3+的方程式是取少量滤液,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+,反之,溶液不变红色,说明滤液中不含Fe3+.
(3)“除杂”环节有如下几个步骤,(Ⅰ)向滤液中加入过量的KMnO4溶液,调节溶液的pH为3;(Ⅱ)加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;(Ⅲ)加入MnSO4至紫红色消失、过滤.
①配平下列离子方程式:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
②调节溶液的pH为3的目的是pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀;
③向Ⅱ中的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是生成黄绿色气体,写出其反应的化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑;
④Ⅲ中加入MnSO4的目的是除去过量的MnO4-.
(4)从多次循环使用后母液中可回收的主要物质是K2SO4(填化学式)
8. 黄曲霉素AFTB(见图)是污染粮食的真菌霉素,人类的特殊基因在黄曲霉素作用下会发生突变,并有引发肝癌的可能性.关于黄曲霉素的说法正确的是( )
黄曲霉素AFTB(见图)是污染粮食的真菌霉素,人类的特殊基因在黄曲霉素作用下会发生突变,并有引发肝癌的可能性.关于黄曲霉素的说法正确的是( )
 黄曲霉素AFTB(见图)是污染粮食的真菌霉素,人类的特殊基因在黄曲霉素作用下会发生突变,并有引发肝癌的可能性.关于黄曲霉素的说法正确的是( )
黄曲霉素AFTB(见图)是污染粮食的真菌霉素,人类的特殊基因在黄曲霉素作用下会发生突变,并有引发肝癌的可能性.关于黄曲霉素的说法正确的是( )| A. | 该化合物的分子式为C16H12O6 | |
| B. | 该化合物水解可生成醇类化合物 | |
| C. | 跟1mol该化合物反应的H2和NaOH的最大值分别是6mol和2mol | |
| D. | 该化合物所有原子可能在同一平面上 |
15.3-氯戊烷是-种有机合成中间体,下列有关3-氯戊烷的叙述正确的是( )
| A. | 3-氯戊烷的分子式为C6H9Cl3 | B. | 3-氯戊烷属于烷烃 | ||
| C. | 3-氯戊烷的一溴代物共有3种 | D. | 3-氯戊烷的同分异构体共有6种 |
5.某化合物的结构式 (键线式)及球棍模型如图1:该有机分子的核磁共振氢谱图如图2(单位是ppm).下列关于该有机物的叙述正确的是( )
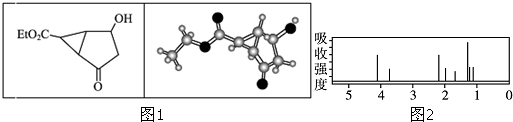

| A. | 该有机物不同化学环境的氢原子有8种 | |
| B. | 该有机物属于芳香族化合物 | |
| C. | 键线式中的Et代表的基团为-CH3 | |
| D. | 利用质谱法不能确定该有机物的相对分子质量 |