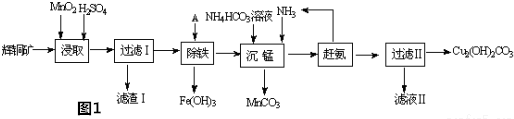
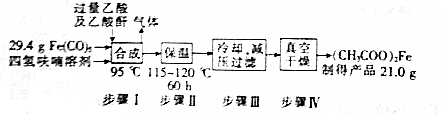
题目内容
2.Se是人体必需微量元素,下列有关${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se说法正确的是( )| A. | ${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se是同一种核素 | |
| B. | ${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se互为同位素 | |
| C. | ${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se分别含有44和46个质子 | |
| D. | ${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se都含有34个中子 |
分析 A.二者质子数相同,中子数不同,属于不同的核素;
B.同一种元素的不同核素,互为同位素;
C.同种元素的原子一定具有相同的质子数,二者质子数都是34;
D.中子数=质量数-质子数,元素符号的左上角表示的是质量数,左下角表示的是质子数.
解答 解:A、${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se质子数相同,中子数不同,属于不同的核素,故A错误;
B、3478Se和3480Se是同一种元素的不同核素,互为同位素,故B正确;
C、3478Se和3480Se的中子数分别为44和46,故C错误;
D、Se的两种同位素的质子数都为34,故D错误;
故选B.
点评 本题考查了原子结构、核素的判断,题目难度不大,注意掌握原子构成及表示方法,明确同位素的概念及质量数=中子数+中子数,试题侧重考查学生的辨别能力.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
13.最近日本科学家确认世界上还存在的另一种“分子足球”N60,它与C60的结构相似.下列说法正确的是( )
| A. | N60和N2是同素异形体 | B. | N60中氮原子之间由共价键结合 | ||
| C. | N60高温或撞击后应该生成N2 | D. | N60和14N都是氮的同位素 |
10.漂白粉在溶液中存在下列平衡体系:ClO-+H2O?HClO+OH-(正反应为吸热反应),以下措施能增强漂白粉的漂白效果的是( )
| A. | 降低温度 | B. | 加入大量的水 | ||
| C. | 加入适量盐酸 | D. | 加入适量烧碱溶液 |
17.下列说法中正确的是( )
| A. | 物质发生化学反应都伴随着能量变化 | |
| B. | 伴有能量变化的物质变化都是化学变化 | |
| C. | 在一个确定的化学反应关系中,反应物的总能量与生产物的总能量有可能相同 | |
| D. | 如果旧化学键断裂吸收的能量大于新化学键形成释放的能量,则该反应为放热反应 |
14.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 常温下,22gCO2含碳氧双键数目为2NA | |
| B. | 标准状况下,22.4LBr2中所含分子数为NA | |
| C. | 12.0NaHSO4晶体中含阳离子数目为0.1NA | |
| D. | 7.8gNa2O2与足量 的水反应转移电子数目为0.2NA |
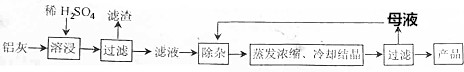
11.用含有Al2O3、SiO2和少量FeO•xFe2O3的铝灰制备Al2(SO4)3•18H2O的工艺流程图如下(部分操作和条件略):
已知:生成氢氧化物沉淀的pH
注:金属离子的起始浓度为0.1mol•L-1.
(1)H2SO4溶解Al2O3的离子方程式是Al2O3+6H+=2Al3++3H2O.
(2)检验溶液中还存在Fe3+的方程式是取少量滤液,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+,反之,溶液不变红色,说明滤液中不含Fe3+.
(3)“除杂”环节有如下几个步骤,(Ⅰ)向滤液中加入过量的KMnO4溶液,调节溶液的pH为3;(Ⅱ)加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;(Ⅲ)加入MnSO4至紫红色消失、过滤.
①配平下列离子方程式:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
②调节溶液的pH为3的目的是pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀;
③向Ⅱ中的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是生成黄绿色气体,写出其反应的化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑;
④Ⅲ中加入MnSO4的目的是除去过量的MnO4-.
(4)从多次循环使用后母液中可回收的主要物质是K2SO4(填化学式)

已知:生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
(1)H2SO4溶解Al2O3的离子方程式是Al2O3+6H+=2Al3++3H2O.
(2)检验溶液中还存在Fe3+的方程式是取少量滤液,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+,反之,溶液不变红色,说明滤液中不含Fe3+.
(3)“除杂”环节有如下几个步骤,(Ⅰ)向滤液中加入过量的KMnO4溶液,调节溶液的pH为3;(Ⅱ)加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;(Ⅲ)加入MnSO4至紫红色消失、过滤.
①配平下列离子方程式:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
②调节溶液的pH为3的目的是pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀;
③向Ⅱ中的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是生成黄绿色气体,写出其反应的化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑;
④Ⅲ中加入MnSO4的目的是除去过量的MnO4-.
(4)从多次循环使用后母液中可回收的主要物质是K2SO4(填化学式)