题目内容
19. 把镁铝合金用稀H2SO4溶液完全溶解后,在所得溶液中加入KOH溶液的体积与生成沉淀的质量关系如图所示,则合金中镁与铝的质量比是( )
把镁铝合金用稀H2SO4溶液完全溶解后,在所得溶液中加入KOH溶液的体积与生成沉淀的质量关系如图所示,则合金中镁与铝的质量比是( )| A. | 1:1 | B. | 8:9 | C. | 4:3 | D. | 4:9 |
分析 由图象可知,金属与酸反应时酸过量,利用7~8体积发生的反应为Al(OH)3+KOH═KAlO2+2H2O来计算Al的量,由1~7体积发生Al3++3OH-═Al(OH)3↓、Mg2++2OH-═Mg(OH)2↓来计算Mg的量,然后计算合金中镁和铝的质量比.
解答 解:设KOH的浓度为cmol/L,合金中Al的物质的量为x,Mg的物质的量为y,
由7~8体积发生的反应为Al(OH)3+KOH═KAlO2+2H2O,则
Al~Al(OH)3~NaOH
1 1
x (8-7)×0.001L×c
x=0.001cmol,
由1~7体积发生Al3++3OH-═Al(OH)3↓、Mg2++2OH-═Mg(OH)2↓,则
Al3++3OH-═Al(OH)3↓
1 3
0.001cmol 0.003cmol
Mg2++2OH-═Mg(OH)2↓
1 2
y (0.006c-0.003c)mol
y=0.0015cmol,
则合金中镁和铝的质量比为0.0015cmol×24g/mol:0.001cmol×27g/mol=4:3,
故选C.
点评 本题考查镁、铝及其化合物的性质,明确发生的化学反应及反应与图象的关系是解答本题的关键,难度不大.

练习册系列答案
相关题目
4.下列说法正确的是( )
| A. | 在酒精灯加热条件下,Na2CO3、NaHCO3固定都能发生分解 | |
| B. | 不可用元素周期律解释热稳定性:Na2CO3>NaHCO3 | |
| C. | 分别加热Na2CO3和NaHCO3固体,试管内壁均有水珠,则两种物质均受热分解 | |
| D. | 1L0.1mol•L-1NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA |
11.下列有关钠及其化合物用途的说法不正确的是( )
| A. | 钠-钾合金可在核反应堆中用作热交换液 | |
| B. | 过氧化钠可用作潜水艇中的供氧剂 | |
| C. | 纯碱可用作治疗胃酸过多的药剂 | |
| D. | 碳酸氢钠溶液用于制泡沫灭火剂 |
14.下列实验操作中,正确的是( )
| A. | 在蒸发食盐水时,边加热边用玻璃棒搅拌直至液体蒸干 | |
| B. | 鉴别Na2CO3与NaHCO3固体可用加热的方法 | |
| C. | 实验室制备氢氧化铁胶体时,向饱和氯化铁溶液中滴加氢氧化钠溶液 | |
| D. | 配制一定物质的量浓度的NaOH溶液,将NaOH固体放在容量瓶中加水溶解 |
15.从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4=3Br2+Na2SO4+3H2O,与该反应在氧化还原反应原理上最相似的是( )
| A. | 2NaBr+Cl2=2CaCl+Br2 | |
| B. | AlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3NaCl | |
| C. | 2H2S+SO2=2H2O+3S↓ | |
| D. | 2CO+O2=2CO2 |
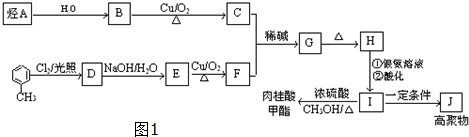
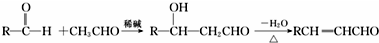
 $→_{△}^{硫酸}$
$→_{△}^{硫酸}$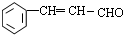 +H2O.
+H2O.