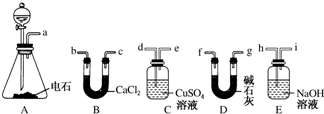
题目内容
15.从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4=3Br2+Na2SO4+3H2O,与该反应在氧化还原反应原理上最相似的是( )| A. | 2NaBr+Cl2=2CaCl+Br2 | |
| B. | AlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3NaCl | |
| C. | 2H2S+SO2=2H2O+3S↓ | |
| D. | 2CO+O2=2CO2 |
分析 5NaBr+NaBrO3+3H2SO4=3Br2+Na2SO4+3H2O中只有Br元素的化合价变化,为归中反应,结合选项中元素的化合价变化来解答.
解答 解:A.Br、Cl两种元素的化合价变化,故A不选;
B.无元素的化合价变化,故B不选;
C.只有S元素的化合价变化,为归中反应,故C选;
D.C、O两种元素的化合价变化,故D不选;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意常见元素的化合价判断,题目难度不大.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
19.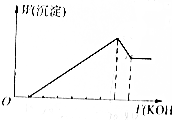 把镁铝合金用稀H2SO4溶液完全溶解后,在所得溶液中加入KOH溶液的体积与生成沉淀的质量关系如图所示,则合金中镁与铝的质量比是( )
把镁铝合金用稀H2SO4溶液完全溶解后,在所得溶液中加入KOH溶液的体积与生成沉淀的质量关系如图所示,则合金中镁与铝的质量比是( )
 把镁铝合金用稀H2SO4溶液完全溶解后,在所得溶液中加入KOH溶液的体积与生成沉淀的质量关系如图所示,则合金中镁与铝的质量比是( )
把镁铝合金用稀H2SO4溶液完全溶解后,在所得溶液中加入KOH溶液的体积与生成沉淀的质量关系如图所示,则合金中镁与铝的质量比是( )| A. | 1:1 | B. | 8:9 | C. | 4:3 | D. | 4:9 |
10.如图是学校实验室从化学试剂商品店买回的硫酸试剂标签上的部分内容,据此,下列说法正确的是( )


| A. | 该硫酸的物质的量浓度为18.4 mol/L | |
| B. | 1 mol Zn与足量的该硫酸反应产生2 g氢气 | |
| C. | 配制200 mL 4.6 mol/L的稀硫酸需取该硫酸50.0 mL | |
| D. | 该硫酸与等质量的水混合所得溶液的物质的量浓度大于9.2 mol/L |
20.NA为阿伏加德罗常数值,下列说法中正确的是( )
| A. | 标准状况下,11.2L四氯化碳所含分子数为0.5NA | |
| B. | 1L1mol/l的盐酸溶液中,所含氯化氢分子数为NA | |
| C. | 标准状况下,0.5molCO2所占的体积约为11.2L | |
| D. | 11.2L氧气所含的原子数为NA |
7.一定条件下硝酸铵受热分解的化学方程式为:3Cu+8HNO3=3Cu (NO3)2+2NO↑+4H2O,在反应中被还原与未被还原的氮原子数之比为( )
| A. | 8:3 | B. | 3:2 | C. | 1:3 | D. | 3:8 |
4.X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是原子半径最小的元素,Y的最高正价与最低负价的代数和为0,Z的二价阳离子与氖原子具行相同的核外电子排布,W原子最外层电子数是最内层电子数的3倍.下列说法正确的是( )
| A. | X与Y形成的化合物只有一种 | |
| B. | 原子半径:r(Z)<r(R) | |
| C. | R的氯化物的热稳定性比W的强 | |
| D. | Y的最高价氧化物对应水化物的酸性比W的强 |
5.设NA 表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,0.1 mol Cl2被氢氧化钠溶液完全吸收,转移的电子数目为0.2NA | |
| B. | 标准状况下,11.2 L CH3OH中含有的共价键数目为2.5NA | |
| C. | 常温常压下,2.24 L CO和CO2混合气体中含有的碳原子数目为0.1NA | |
| D. | 常温常压下,16 g CH4中含有的原子总数为5NA |