题目内容
9.由H2、C2H2、C2H4组成的1L混合气体在一定条件下发生加成反应,反应后气体总体积变成xL(气体体积均在标准状况下测定),请回答:(1)当反应后三种气体均无剩余时,x的取值范围是多少?若x=0.4时,原混合气体H2、C2H2、C2H4的体积比是多少?
(2)当x=0.6且反应后混合气体密度为0.714g/L时,原混合气体H2、C2H2、C2H4的体积比是多少?
分析 (1)由H2、C2H2、C2H4组成的1L混合气体在一定条件下发生加成反应,方程式分别为2H2+C2H2→C2H6,H2+C2H4→C2H6,可利用端值法计算x的取值范围,结合方程式计算x=0.4时,原混合气体H2、C2H2、C2H4的体积比;
(2)当x=0.6且反应后混合气体密度为0.714g/L时,气体的平均相对分子质量为0.714×22.4=16,说明氢气过量,反应后的气体为氢气和乙烷,根据相对分子质量计算二者的体积之比,可计算氢气和乙烷的体积,然后利用反应前后的体积关系列方程组计算体积比.
解答 解:(1)由H2、C2H2、C2H4组成的1L混合气体在一定条件下发生加成反应,方程式分别为2H2+C2H2→C2H6,H2+C2H4→C2H6,由方程式可知,如果恰好是乙烯和氢气加成,则x=0.5,如果恰好是乙炔和氢气加成,则x=$\frac{1}{3}$,所以x的取值范围是$\frac{1}{3}$<x<$\frac{1}{2}$,
设原混合气体H2、C2H2、C2H4的体积分别为x、y、z,则根据方程式可知$\left\{\begin{array}{l}{x+y+z=1}\\{2y+z=0.4}\\{y+z=0.4}\end{array}\right.$,
所以解得x=0.6,y=0.2,z=0.2,
因此混合气体H2、C2H2、C2H4的体积比是3:1:1,
答:原混合气体H2、C2H2、C2H4的体积比是3:1:1;
(2)当x=0.6且反应后混合气体密度为0.714g/L时,气体的平均相对分子质量为0.714×22.4=16,说明氢气过量,因此反应后的气体是乙烷和氢气的混合气,则二者的体积之比是$\frac{16-2}{30-16}$=1:1,所以反应后含有0.3L氢气和0.3L乙烷,
设原混合气体H2、C2H2、C2H4的体积分别为a、b、c,
则a+b+c=1,b+c=0.3,所以a=0.7,又因为2b+c=0.7-0.3=0.4,所以c=0.1,则b=0.2,
因此原混合气体H2、C2H2、C2H4的体积比为7:2:1,
答:原混合气体H2、C2H2、C2H4的体积比是7:2:1.
点评 本题考查了混合物反应的计算,为高频考点,题目难度中等,明确掌握极值法、十字相乘法在化学计算中的应用为解答关键,试题培养了学生的分析、理解能力及化学计算能力.

| A. | 纸 | B. | 铅笔芯 | C. | 塑料文具盒 | D. | 橡皮擦 |

①中涉及的主要反应有:
主反应:4FeO•Cr2O3+8Na2CO3+7O2$\frac{\underline{\;\;△\;\;}}{\;}$8Na2CrO4+2Fe2O3+8CO2
副反应:SiO2+Na2CO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2SiO3+CO2↑、Al2O3+Na2CO3$\frac{\underline{\;\;△\;\;}}{\;}$2NaAlO2+CO2↑
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 |
| 完全沉淀时溶液pH | 4.7 | 3.7 | 11.2 | 5.6 |
(1)“①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是使反应物接触更充分,加快反应速率.
(2)“③”中调节pH至4.7,目的是除去溶液中的AlO2-、SiO32-.
(3)“⑤”中加硫酸酸化的目的是使CrO42-转化为Cr2O72-,请写出该平衡转化的离子方程式:2CrO42-+2H+?Cr2O72-+H2O.
(4)称取重铬酸钠试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL 2mol•L-1H2SO4和足量碘化钠(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol•L-1Na2S2O3标准溶液滴定(I2+2S2O32-═2I-+S4O62-).
①判断达到滴定终点的依据是:当滴加最后一滴硫代硫酸钠溶液时,溶液蓝色褪去,半分钟内不变色;
②若实验中共用去Na2S2O3标准溶液40.00ml,所得产品的中重铬酸钠的纯度(设整个过程中其它杂质不参与反应)83.84%.

| A. | ⑤②①④③ | B. | ③②⑤④① | C. | ⑤④②③① | D. | ⑤②①③④ |
| 实验现象 |
| (A) |
| (B)反应不十分强烈,产生的气体可在空气中燃烧 |
| (C)剧烈反应,产生可燃性气体 |
| (D)生成白色胶状沉淀,然后沉淀消失 |
| (E)产生气体,可在空气中燃烧,溶液变成浅红色 |
| 实验方案 |
| 1.用砂纸打磨后的镁带加适量水加热,再向反应后溶液中滴加酚酞 |
| 2.钠与滴有酚酞的试液的冷水反应 |
| 3.镁带与2mol/L的盐酸反应 |
| 4.铝条与2mol/L的盐酸反应 |
| 5.向氯化铝溶液中滴加氢氧化钠溶液至过量 |
(1)实验的目的验证第三周期金属元素的金属性的递变规律;
(2)实验内容:与实验方案1-5对应的实验现象依次为E、A、C、B、D(填:字母编号);实验现象(A)为:钠浮在水面上,熔化化成小球,四处游动,发出嘶嘶响声,溶液变红;
(3)实验结论同周期从左到右元素的金属性逐渐减弱.
| A. | 漂白粉的有效成份是氯酸钙 | B. | 氟化氢溶于水形成的氢氟酸是强酸 | ||
| C. | 碘化钾水溶液能使淀粉变蓝 | D. | 氟气通入水中有氧气生成 |
| A. | CO2 | B. | H2O | C. | NaOH | D. | H2SO4 |
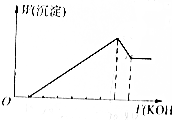 把镁铝合金用稀H2SO4溶液完全溶解后,在所得溶液中加入KOH溶液的体积与生成沉淀的质量关系如图所示,则合金中镁与铝的质量比是( )
把镁铝合金用稀H2SO4溶液完全溶解后,在所得溶液中加入KOH溶液的体积与生成沉淀的质量关系如图所示,则合金中镁与铝的质量比是( )| A. | 1:1 | B. | 8:9 | C. | 4:3 | D. | 4:9 |