题目内容
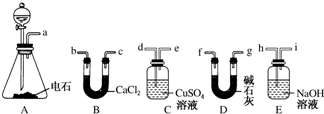
14.下列实验操作中,正确的是( )| A. | 在蒸发食盐水时,边加热边用玻璃棒搅拌直至液体蒸干 | |
| B. | 鉴别Na2CO3与NaHCO3固体可用加热的方法 | |
| C. | 实验室制备氢氧化铁胶体时,向饱和氯化铁溶液中滴加氢氧化钠溶液 | |
| D. | 配制一定物质的量浓度的NaOH溶液,将NaOH固体放在容量瓶中加水溶解 |
分析 A.蒸发时不能蒸干,利用余热加热;
B.NaHCO3加热分解,Na2CO3不能;
C.饱和氯化铁溶液中滴加氢氧化钠溶液,生成沉淀;
D.NaOH烧杯中溶解,容量瓶中不能溶解固体.
解答 解:A.蒸发时不能蒸干,利用余热加热,则在蒸发食盐水时,边加热边用玻璃棒搅拌直至出现大量固体时停止加热,故A错误;
B.NaHCO3加热分解,Na2CO3不能,则加热可鉴别,故B正确;
C.饱和氯化铁溶液中滴加氢氧化钠溶液,生成沉淀,应利用氯化铁溶液在沸水中水解制备胶体,故C错误;
D.NaOH烧杯中溶解,容量瓶中不能溶解固体,应在烧杯中溶解后冷却至室温,再转移到容量瓶中,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、混合物分离提纯、溶液配制及胶体制备等为解答的关键,侧重分析与实验能力的考查,注意实验评价性分析,题目难度不大.

练习册系列答案
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
18.下列物质属于离子化合物的是( )
| A. | CO2 | B. | H2O | C. | NaOH | D. | H2SO4 |
19.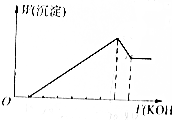 把镁铝合金用稀H2SO4溶液完全溶解后,在所得溶液中加入KOH溶液的体积与生成沉淀的质量关系如图所示,则合金中镁与铝的质量比是( )
把镁铝合金用稀H2SO4溶液完全溶解后,在所得溶液中加入KOH溶液的体积与生成沉淀的质量关系如图所示,则合金中镁与铝的质量比是( )
 把镁铝合金用稀H2SO4溶液完全溶解后,在所得溶液中加入KOH溶液的体积与生成沉淀的质量关系如图所示,则合金中镁与铝的质量比是( )
把镁铝合金用稀H2SO4溶液完全溶解后,在所得溶液中加入KOH溶液的体积与生成沉淀的质量关系如图所示,则合金中镁与铝的质量比是( )| A. | 1:1 | B. | 8:9 | C. | 4:3 | D. | 4:9 |
19.在标准状况下将19.2g铜粉投入一定量浓HNO3中随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由NO2和NO组成的混和气体8.96L,则混和气体中NO的体积为( )
| A. | 2240mL | B. | 1008mL | C. | 3360mL | D. | 448mL |
4.X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是原子半径最小的元素,Y的最高正价与最低负价的代数和为0,Z的二价阳离子与氖原子具行相同的核外电子排布,W原子最外层电子数是最内层电子数的3倍.下列说法正确的是( )
| A. | X与Y形成的化合物只有一种 | |
| B. | 原子半径:r(Z)<r(R) | |
| C. | R的氯化物的热稳定性比W的强 | |
| D. | Y的最高价氧化物对应水化物的酸性比W的强 |