题目内容
2.在下列反应中,水既不是氧化剂,也不是还原剂的是( )| A. | 2Na+2H2O=2NaOH+H2↑ | B. | C12+H2O=HC1+HC1O | ||
| C. | 2F2+2H2O=4HF+O2 | D. | 2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑ |
分析 水既不是氧化剂又不是还原剂,则在反应中,水所含的H元素和O元素的化合价没有发生变化,氧化还原反应中有元素的化合价发生变化,以此解答该题.
解答 解:A.2Na+2H2O=2NaOH+H2↑,H元素的化合价降低,水被还原,为氧化剂,故A错误;
B.Cl2+H2O?HCl+HClO,反应中Cl元素化合价由0价变为+1价、-1价,水中各元素化合价不变,所以水既不是氧化剂也不是还原剂,故B正确;
C.2F2+2H2O=4HF+O2,反应中F元素化合价由0价变为-1价、O元素化合价由-2价变为0价,所以水是还原剂,故C错误;
D.2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,H2O中H元素的化合价降低,O元素化合价升高,所以水既是氧化剂又是还原剂,故D错误.
故选B.
点评 本题考查氧化还原反应,题目难度不大,注意根据物质的性质判断所发生的反应,注意元素化合价的变化.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
10.下列变化不属化学科学研究的范畴的是( )
| A. | 电解水生成氢气和氧气 | B. | 合成有机高分子材料 | ||
| C. | 原子弹发生剧烈爆炸 | D. | 生产合成纤维和合成橡胶 |
17.在100℃时,将0.200mol的四氧化二氮气体充入2L抽空的密闭容器中,每隔一定时间对该容器内的物质进行分析,得到如下表格:
试填空:
(1)该反应的化学方程式为N2O4(g)?2 NO2(g),
(2)达到平衡时四氧化二氮的转化率为60%.
(3)20s时四氧化二氮的浓度c1=0.07 mol•L-1,
(4)在0~20s时间段内,二氧化氮的平均反应速率为0.003mol/(L.s).
| 时间(S) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) mol | 0.200 | c1 | 0.10 | c3 | a | b |
| n(NO2) mol | 0.000 | 0.120 | c2 | 0.240 | 0.240 | 0.240 |
(1)该反应的化学方程式为N2O4(g)?2 NO2(g),
(2)达到平衡时四氧化二氮的转化率为60%.
(3)20s时四氧化二氮的浓度c1=0.07 mol•L-1,
(4)在0~20s时间段内,二氧化氮的平均反应速率为0.003mol/(L.s).
7.可逆反应达到平衡状态的主要特征是( )
| A. | 正、逆反应的速率均为零 | B. | 正、逆反应都还在进行 | ||
| C. | 正、逆反应的速率相等 | D. | 反应停止了 |
 A、B、C、D、E五种物分别是NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:
A、B、C、D、E五种物分别是NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:


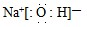 ;
;