��Ŀ����
15��һ���¶��£����ܱ������н��з�Ӧ��4A��s ��+3B��g��?2C��g��+D��g������2min��B��Ũ�ȼ���0.6mol•L-1���Դ˷�Ӧ�ķ�Ӧ���ʵı�ʾ����ȷ���ǣ�����������2minĩ�ķ�Ӧ���ʣ���B��ʾ��0.3mol•L-1•min-1
�ڷ�Ӧ�Ĺ����У�ֻ����A��������Ӧ���ʲ���
����A��ʾ�ķ�Ӧ������0.4mol•L-1•min-1
�ֱܷ���B��C��D��ʾ�ķ�Ӧ�������ֵΪ3��2��1��
| A�� | �٢� | B�� | �� | C�� | �� | D�� | �ڢ� |
���� ����B��ʾ�ķ�Ӧ����0.3mol•L-1•min-1Ϊǰ2min�ڵ�ƽ�����ʣ�
�ڸ÷�Ӧ��A�ǹ��壬����A�������ı�A��Ũ�ȣ�
��A�ǹ��壬��Ӧ��û��Ũ�ȱ仯�������Բ�����A��ʾ��ѧ��Ӧ���ʣ�
��ͬһ��Ӧ��ͬһ��ʱ���ڸ����ʵķ�Ӧ����֮�ȵ����������֮�ȣ��������������Һ����
��� �⣺����B��ʾ�ķ�Ӧ����0.3mol•L-1•min-1Ϊǰ2min�ڵ�ƽ�����ʶ�����˲ʱ���ʣ���Ũ��Խ��Ӧ����Խ����2minĩʱB�ķ�Ӧ����С��0.3mol•L-1•min-1���ʴ���
�ڸ÷�Ӧ��A�ǹ��壬û��Ũ�ȣ�����A�������ı�A��Ũ�ȣ��ı仯ѧ��Ӧ���ʣ�����ȷ��
��A�ǹ��壬��Ӧ��û��Ũ�ȱ仯�������Բ�����A��ʾ��ѧ��Ӧ���ʣ��ʴ���
��ͬһ��Ӧ��ͬһ��ʱ���ڸ����ʵķ�Ӧ����֮�ȵ����������֮�ȣ��������������Һ�������Էֱ���B��C��D��ʾ�ķ�Ӧ�������ֵΪ3��2��1������ȷ��
��ѡD��
���� ���⿼�黯ѧƽ���йؼ��㣬Ϊ��Ƶ���㣬���ؿ���ѧ������������������ȷ��ѧ��Ӧ���ʸ�����÷�Χ����ѧ��Ӧ������������Ĺ�ϵ�ǽⱾ��ؼ���ע��÷�Ӧ��A�ǹ��壬��Ŀ�ѶȲ���

��ϰ��ϵ�д�
 ����ѧ���ʱѧ����ϵ�д�
����ѧ���ʱѧ����ϵ�д� �ʰ�Ӣ��ͬ����ϰ��ϵ�д�
�ʰ�Ӣ��ͬ����ϰ��ϵ�д�
�����Ŀ
6�����з�Ӧ�������ȷ�Ӧ���ǣ�������
| A�� | ̿ȼ������һ����̼ | B�� | Ba��OH��2•8H2O��NH4Cl��Ӧ | ||
| C�� | п����ϡ���ᷴӦ��ȡH2 | D�� | �кͷ�Ӧ |
10�����б仯������ѧ��ѧ�о��ķ�����ǣ�������
| A�� | ���ˮ�������������� | B�� | �ϳ��л��߷��Ӳ��� | ||
| C�� | ԭ�ӵ��������ұ�ը | D�� | �����ϳ���ά�ͺϳ��� |
20��ij��Ӧ���������仯��ͼ��ʾ������˵����ȷ���ǣ�������
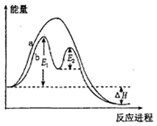

| A�� | ��Ӧ����a�д������� | |
| B�� | �÷�ӦΪ���ȷ�Ӧ | |
| C�� | �ı�������ɸı�÷�Ӧ�Ļ�� | |
| D�� | �д��������£���Ӧ�Ļ�ܵ���E1+E2 |
7�����淴Ӧ�ﵽƽ��״̬����Ҫ�����ǣ�������
| A�� | �����淴Ӧ�����ʾ�Ϊ�� | B�� | �����淴Ӧ�����ڽ��� | ||
| C�� | �����淴Ӧ��������� | D�� | ��Ӧֹͣ�� |
15��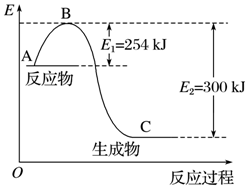 ���ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���ã�
���ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���ã�
��1����ͼ��N2��g����H2��g����Ӧ����1mol NH3��g�������������ı仯ʾ��ͼ����д��N2��H2��Ӧ���Ȼ�ѧ����ʽ��N2��g��+3H2��g��=2NH3��g����H=-92KJ/mol��
��2������֪�������ݣ�
�Ը��ݱ��м�ͼ�����ݼ���N-H�ļ��ܣ�390kJ•mol-1��
��3����NH3����ԭNOx���������������������Ⱦ����֪��
4NH3��g��+3O2��g���T2N2+6H2O��g����H1=-a kJ•mol-1��
N2��g��+O2��g���T2NO��g����H2=-b kJ•mol-1��
����1mol NH3��ԭNO��N2����÷�Ӧ�����еķ�Ӧ�ȡ�H3=$\frac{3b-a}{4}$kJ•mol-1���ú�a��b��ʽ�ӱ�ʾ����
��4����̼��������Ҫָ����CO2���ڽ������������ŷ��о�����Ҫ�����ã�ĿǰNH3�ͣ�NH4��2CO3�Ѿ���������ҵ��̼����������CO2�ɷ������¿��淴Ӧ��
��Ӧ��2NH3��l��+H2O��l��+CO2��g��?��NH4��2CO3��aq����H1
��Ӧ��NH3��l��+H2O��l��+CO2��g��?NH4HCO3��aq����H2
��Ӧ��NH4��2CO3��aq��+H2O��l��+CO2��g��?2NH4HCO3��aq����H3
��ش��������⣺
��H3���H1����H2֮��Ĺ�ϵ�ǡ�H3=2��H2-��H1��
 ���ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���ã�
���ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���ã���1����ͼ��N2��g����H2��g����Ӧ����1mol NH3��g�������������ı仯ʾ��ͼ����д��N2��H2��Ӧ���Ȼ�ѧ����ʽ��N2��g��+3H2��g��=2NH3��g����H=-92KJ/mol��
��2������֪�������ݣ�
| ��ѧ�� | H-H | N��N |
| ����/kJ•mol-1 | 435 | 943 |
��3����NH3����ԭNOx���������������������Ⱦ����֪��
4NH3��g��+3O2��g���T2N2+6H2O��g����H1=-a kJ•mol-1��
N2��g��+O2��g���T2NO��g����H2=-b kJ•mol-1��
����1mol NH3��ԭNO��N2����÷�Ӧ�����еķ�Ӧ�ȡ�H3=$\frac{3b-a}{4}$kJ•mol-1���ú�a��b��ʽ�ӱ�ʾ����
��4����̼��������Ҫָ����CO2���ڽ������������ŷ��о�����Ҫ�����ã�ĿǰNH3�ͣ�NH4��2CO3�Ѿ���������ҵ��̼����������CO2�ɷ������¿��淴Ӧ��
��Ӧ��2NH3��l��+H2O��l��+CO2��g��?��NH4��2CO3��aq����H1
��Ӧ��NH3��l��+H2O��l��+CO2��g��?NH4HCO3��aq����H2
��Ӧ��NH4��2CO3��aq��+H2O��l��+CO2��g��?2NH4HCO3��aq����H3
��ش��������⣺
��H3���H1����H2֮��Ĺ�ϵ�ǡ�H3=2��H2-��H1��

