题目内容
9. 新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害.目前降低尾气的可行方法是在汽车排气管上安装催化转化器.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生反应:2CO(g)+2NO(g)?N2(g)+2CO2(g)△H=-a kJ•mol-1.
新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害.目前降低尾气的可行方法是在汽车排气管上安装催化转化器.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生反应:2CO(g)+2NO(g)?N2(g)+2CO2(g)△H=-a kJ•mol-1.(1)CO2的电子式为
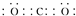 .
.(2)已知2NO(g)+O2(g)=2NO2(g)△H=-b kJ•mol-1;CO的燃烧热△H=-c kJ•mol-1.书写在消除汽车尾气中NO2的污染时,NO2与CO的可逆反应的热化学反应方程式4CO(g)+2NO2(g)=N2(g)+4CO2(g)△H=(-a+b-2c)kJ•mol-1.
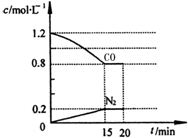
(3)在一定温度下,将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图所示:
①有害气体NO的转化率为40%,0~15min NO的平均速率v(NO)=0.027mol/(L•min).
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是cd(选填序号).
a.缩小容器体积 b.增加CO的量 c.降低温度 d.扩大容器体积
③若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,化学平衡将向左移动(选填“向左”、“向右”或“不”),移动后在达到平衡时的平衡常数是$\frac{5}{36}$L/mol或0.14L/mol.
分析 (1)二氧化碳为共价化合物,结构式为O=C=O;
(2)2CO(g)+2NO(g)=N2(g)+2CO2(g)△H=-a kJ•mol-1①
2NO(g)+O2(g)=2NO2(g)△H=-b kJ•mol-1②
CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-c kJ•mol-1③
由盖斯定律可知①-②+2×③得 4CO(g)+2NO2(g)=N2(g)+4CO2(g);
(3)①将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,由图可知生成氮气为0.2mol,则
2CO(g)+2NO(g)?N2(g)+2CO2(g)
起始浓度(mol•L-1) 1.2 1 0 0
转化浓度(mol•L-1) 0.4 0.4 0.2 0.4
平衡浓度(mol•L-1) 0.8 0.6 0.2 0.4
②改变反应条件,导致CO浓度减小,可使平衡正向移动,但不能加CO或缩小体积;
③结合Qc与K的关系判断反应的移动方向.
解答 解:(1)二氧化碳为共价化合物,结构式为O=C=O,则CO2的电子式为 ,
,
故答案为: ;
;
(2)2CO(g)+2NO(g)=N2(g)+2CO2(g)△H=-a kJ•mol-1①
2NO(g)+O2(g)=2NO2(g)△H=-b kJ•mol-1②
CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-c kJ•mol-1③
由①-②+2×③得 4CO(g)+2NO2(g)=N2(g)+4CO2(g)△H=(-a+b-2c) kJ•mol-1,
故答案为:4CO(g)+2NO2(g)=N2(g)+4CO2(g)△H=(-a+b-2c) kJ•mol-1;
(3)①将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,则
2CO(g)+2NO(g)?N2(g)+2CO2(g)
起始浓度(mol•L-1) 1.2 1 0 0
转化浓度(mol•L-1) 0.4 0.4 0.2 0.4
平衡浓度(mol•L-1) 0.8 0.6 0.2 0.4
有害气体NO的转化率为$\frac{0.4}{1}$×100%=40%;0~15min NO的平均速率v(NO)=$\frac{0.4mol/L}{15min}$=0.027mol/(L•min),化学平衡常数K=$\frac{{0.2×{{0.4}^2}}}{{0.8×{{0.6}^2}}}$=0.14,
故答案为:40%;0.027mol/(L•min);
②a.缩小容器体积,CO浓度增大,故a错误;
b.增加CO的量,CO浓度增大,故b错误;
c.降低温度,正向移动,CO浓度减小,故c正确;
d.扩大容器体积,CO浓度减小,故d正确;
故答案为:c d;
③20min时再向容器中充入NO、N2各0.4mol,此时各成分的浓度变为
2CO(g)+2NO(g)?N2(g)+2CO2(g)
瞬时浓度(mol•L-1) 0.8 0.6 0.4 0.6
Qc=$\frac{{0.4×{{0.6}^2}}}{{0.8×{{0.6}^2}}}$=0.625>0.14,所以逆向移动;化学平衡常数只和温度有关,温度不变,平衡常数不变,所以化学平衡常数还是$\frac{5}{36}$L/mol或0.14 L/mol,
故答案为:逆向;$\frac{5}{36}$L/mol或0.14 L/mol.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、K的计算、盖斯定律应用为解答的关键,侧重分析与应用能力的考查,注意化学反应原理的综合应用,综合性较强,题目难度不大.

| A. | 能够发生化学反应的碰撞是有效碰撞 | |
| B. | 增大浓度会加快化学反应速率,其原因是增加了单位体积内活化分子的数目 | |
| C. | 稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H=-53.7kJ•mol-1,若将含0.5 molH2SO4的稀硫酸与含0.5molBa(OH)2的溶液混合,放出的热量大于53.7kJ | |
| D. | 若化学平衡正向移动,则反应物的转化率会增大,平衡常数也必发生变化 |
| A. | 电解水生成氢气和氧气 | B. | 合成有机高分子材料 | ||
| C. | 原子弹发生剧烈爆炸 | D. | 生产合成纤维和合成橡胶 |
| A. | 正、逆反应的速率均为零 | B. | 正、逆反应都还在进行 | ||
| C. | 正、逆反应的速率相等 | D. | 反应停止了 |
| A. | 钠燃烧时生成氧化钠 | B. | 钠有很强的还原性 | ||
| C. | 钠原子的最外层只有一个电子 | D. | 钠燃烧时发出黄色火焰 |
(1)Al(NO3)3是制备钠硫电池部件的原料之一.由于Al(NO3)3容易吸收环境中的水分,因此需要对其进行定量分析.具体步骤如图所示:

①加入过量氨水后发生反应的离子方程式为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+.
②操作b为:过滤.
③Al(NO3)3待测液中,c(Al3+)=$\frac{1000m}{51v}$ mol/L(用含m、V的代数式表示).
(2)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2SX)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图1所示:

| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050、 |
| 沸点/℃ | 892 | 444.6 | 2980 |
A.100℃以下 B.100~300℃C.300~350℃D.350~2050℃
②放电时,电极A为负极,电极B发生还原反应(填“氧化或还原”)
③充电时,总反应为Na2SX═2Na+xS(3<x<5),则阳极的电极反应式为:Sx2--2e-═xS.
(3)若把钠硫电池作为电源,电解槽内装有KI及淀粉溶液如图2所示,槽内的中间用阴离子交换膜隔开.通电一段时间后,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.则右侧发生的电极方程式:2H2O+2e-=H2↑+2OH-;试分析左侧溶液蓝色逐渐变浅的可能原因是:右侧溶液中生成的OH-通过阴离子交换膜进入左侧溶液,并与左侧溶液中I2反应.




 ;
;