题目内容
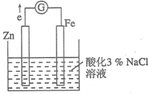 某化学兴趣小组对电化学问题进行了实验探究.利用如图装置探究金属的防护措施,实验现象是锌电极不断溶解,铁电极表面有气泡产生.
某化学兴趣小组对电化学问题进行了实验探究.利用如图装置探究金属的防护措施,实验现象是锌电极不断溶解,铁电极表面有气泡产生.(1)写出负极的电极反应式
(2)某学生认为,铁电极可能参与反应,并对产物作出假设:
假设1:铁参与反应,被氧化生成Fe2+
假设2:铁参与反应,被氧化生成Fe3+
假设3:
(3)为了探究假设1、2,他采取如下操作:
①取0.01mol/L FeCl3溶液2mL于试管中,加入过量铁粉;
②取操作①试管的上层清夜加入2滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③取少量正极附近溶液加入2滴K3[Fe(CN)6]溶液,未见蓝色沉淀生成;
④取少量正极附近溶液加入2滴KSCN溶液,未见溶液变红;
据②、③、④现象得出的结论是
(4)该实验原理可应用于防护钢铁腐蚀,请再举一例防护钢铁腐蚀的措施
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)该装置能自发进行氧化还原反应而形成原电池,锌易失电子而作负极、铁作正极;
(2)铁参与反应,被氧化生成亚铁离子和铁离子;
(3)亚铁离子和K3[Fe(CN)6]生成蓝色沉淀,铁离子和硫氰化钾溶液反应生成血红色溶液;
(4)可以采用物理或化学方法防止金属被腐蚀.
(2)铁参与反应,被氧化生成亚铁离子和铁离子;
(3)亚铁离子和K3[Fe(CN)6]生成蓝色沉淀,铁离子和硫氰化钾溶液反应生成血红色溶液;
(4)可以采用物理或化学方法防止金属被腐蚀.
解答:
解:I.(1)该装置能自发进行氧化还原反应而形成原电池,锌易失电子而作负极、铁作正极,负极上电极反应式为Zn-2e-=Zn2+,故答案为:Zn-2e-=Zn2+;
(2)铁参与反应,被氧化生成Fe2+、Fe3+,故答案为:铁参与反应,被氧化生成Fe2+、Fe3+;
(3)亚铁离子和K3[Fe(CN)6]生成蓝色沉淀,铁离子和硫氰化钾溶液反应生成血红色溶液,据②、③、④现象知,正极附近溶液不含Fe2+、Fe3+,即铁不参与反应,故答案为:正极附近溶液不含Fe2+、Fe3+;
(4)可以采用物理或化学方法防止金属被腐蚀,如:在钢铁表面刷一层油漆、镀铜等,故答案为:在钢铁表面刷一层油漆、镀铜(其他合理答案均可).
(2)铁参与反应,被氧化生成Fe2+、Fe3+,故答案为:铁参与反应,被氧化生成Fe2+、Fe3+;
(3)亚铁离子和K3[Fe(CN)6]生成蓝色沉淀,铁离子和硫氰化钾溶液反应生成血红色溶液,据②、③、④现象知,正极附近溶液不含Fe2+、Fe3+,即铁不参与反应,故答案为:正极附近溶液不含Fe2+、Fe3+;
(4)可以采用物理或化学方法防止金属被腐蚀,如:在钢铁表面刷一层油漆、镀铜等,故答案为:在钢铁表面刷一层油漆、镀铜(其他合理答案均可).
点评:本题以原电池原理为载体考查了铁的探究实验,根据反应现象确定正负极上发生的反应,知道亚铁离子、铜离子的检验方法等,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列排列的顺序正确的是( )
| A、热稳定性:HCl>PH3>H2S |
| B、碱性:NaOH<Mg(OH)2<Al(OH)3 |
| C、原子半径:O>S>Na |
| D、结合氢离子能力:CO32->HCO3->SO42- |
