题目内容
在一定温度下,将4mol SO2与2molO2放入4L的密闭容器中,在一定条件下反应,10分钟时达到平衡:
2SO2+O2?2SO3测得平衡时混合物总物质的量为5mol,求:
(1)10分钟内O2的平均反应速率为 mol/(L?min)
(2)平衡时SO2的转化率 .
2SO2+O2?2SO3测得平衡时混合物总物质的量为5mol,求:
(1)10分钟内O2的平均反应速率为
(2)平衡时SO2的转化率
考点:化学平衡的计算
专题:化学平衡专题
分析:在一定温度下,将4mol SO2与2molO2放入4L的密闭容器中,c(SO2)=1mol/L,c(O2)=0.5mol/L,
设转化的氧气的物质的量为x,则
2SO2+O2?2SO3
开始 4 2 0
转化 2x x 2x
平衡 4-2x 2-x 2x
平衡时混合物总物质的量为5mol,
所以4-2x+2-x+2x=5,解得x=1mol,
(1)利用10min内氧气的浓度变化计算反应速率;
(2)利用转化的二氧化硫与起始的二氧化硫计算转化率.
设转化的氧气的物质的量为x,则
2SO2+O2?2SO3
开始 4 2 0
转化 2x x 2x
平衡 4-2x 2-x 2x
平衡时混合物总物质的量为5mol,
所以4-2x+2-x+2x=5,解得x=1mol,
(1)利用10min内氧气的浓度变化计算反应速率;
(2)利用转化的二氧化硫与起始的二氧化硫计算转化率.
解答:
解:在一定温度下,将4mol SO2与2molO2放入4L的密闭容器中,c(SO2)=1mol/L,c(O2)=0.5mol/L,
设转化的氧气的物质的量为x,则
2SO2+O2?2SO3
开始 4 2 0
转化 2x x 2x
平衡 4-2x 2-x 2x
平衡时混合物总物质的量为5mol,
所以4-2x+2-x+2x=5,解得x=1mol,
(1)10分钟时O2的反应速率为
=0.025mol/(L.nim),故答案为:0.025;
(2)平衡时SO2的转化率为
×100%=50%,故答案为:50%.
设转化的氧气的物质的量为x,则
2SO2+O2?2SO3
开始 4 2 0
转化 2x x 2x
平衡 4-2x 2-x 2x
平衡时混合物总物质的量为5mol,
所以4-2x+2-x+2x=5,解得x=1mol,
(1)10分钟时O2的反应速率为
| ||
| 10min |
(2)平衡时SO2的转化率为
| 2mol |
| 4mol |
点评:本题考查化学平衡的计算,明确化学平衡的三段法计算格式及平衡常数的计算方法是解答本题的关键,注意利用平衡浓度计算平衡常数,题目难度中等.

练习册系列答案
相关题目
对下列有关实验操作和事实解释不正确的是( )
| A、氯水和SO2使品红溶液褪色及SO2可使酸性高锰酸钾溶液褪色的原理不同 |
| B、向某溶液中加入氯化钡溶液生成白色沉淀,再加稀硝酸,白色沉淀不消失该原溶液一定含有SO42- |
| C、用KSCN溶液鉴别FeCl2溶液、FeCl3溶液 |
| D、用氢氟酸雕刻玻璃,是由于氢氟酸能与二氧化硅反应 |

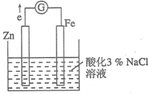 某化学兴趣小组对电化学问题进行了实验探究.利用如图装置探究金属的防护措施,实验现象是锌电极不断溶解,铁电极表面有气泡产生.
某化学兴趣小组对电化学问题进行了实验探究.利用如图装置探究金属的防护措施,实验现象是锌电极不断溶解,铁电极表面有气泡产生.