题目内容
在配制一定物质的量浓度的溶液时,用“偏高、偏低、无影响”表示下列操作对所配溶液浓度的影响.
①用量筒取液态溶质,读数时,俯视量筒,所配制溶液的浓度 .
②将量取液态溶质的量筒用水洗涤,洗涤液倒入容量瓶,所配制溶液的浓度 .
③定容摇匀后,有少量溶液外流,对所配制溶液的浓度 .
①用量筒取液态溶质,读数时,俯视量筒,所配制溶液的浓度
②将量取液态溶质的量筒用水洗涤,洗涤液倒入容量瓶,所配制溶液的浓度
③定容摇匀后,有少量溶液外流,对所配制溶液的浓度
考点:溶液的配制
专题:实验题
分析:根据c=
,判断不当操作对n、V的影响,进而判断溶液浓度的变化.
| n |
| V |
解答:
解:①用量筒取液态溶质,读数时,俯视量筒,会导致所量取的溶液的体积偏小,故所配制溶液的浓度偏低,故答案为:偏低;
②量筒不能洗涤,若将量筒的洗涤液倒入容量瓶,会导致溶质的物质的量偏多,则所配制溶液的浓度 偏高,故答案为:偏高;
③定容摇匀后,有少量溶液外流,对所配制溶液的浓度无影响,故答案为:无影响.
②量筒不能洗涤,若将量筒的洗涤液倒入容量瓶,会导致溶质的物质的量偏多,则所配制溶液的浓度 偏高,故答案为:偏高;
③定容摇匀后,有少量溶液外流,对所配制溶液的浓度无影响,故答案为:无影响.
点评:本题考查一定物质的量浓度的溶液的配制误差分析,题目难度不大,注意仰视、俯视对体积读数的影响.

练习册系列答案
相关题目
 (1)硫酸是重要的化工材料,二氧化硫生成三氧化硫是工业制硫酸的重要反应之一.
(1)硫酸是重要的化工材料,二氧化硫生成三氧化硫是工业制硫酸的重要反应之一.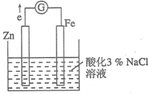 某化学兴趣小组对电化学问题进行了实验探究.利用如图装置探究金属的防护措施,实验现象是锌电极不断溶解,铁电极表面有气泡产生.
某化学兴趣小组对电化学问题进行了实验探究.利用如图装置探究金属的防护措施,实验现象是锌电极不断溶解,铁电极表面有气泡产生.
 (1)如图的键线式表示维生素A的分子结构.
(1)如图的键线式表示维生素A的分子结构.