题目内容
在一定条件下,容积为2L的密闭容器中,将2molL 气体和3molM 气体混合,发生如下反应:2L(g)+3M(g)═xQ(g)+3R(g),10s末,生成2.4molR,并测得Q的浓度为0.4mol?L-1.计算:
(1)10s末L的物质的量浓度为 .
(2)前10s内用M表示的化学反应速率为 .
(3)化学方程式中x值为 .
(4)在恒温恒容条件,往容器中加入1mol氦气,反应速率 (增大、减小、不变)
(5)在恒温恒压条件,往容器中加入1mol氦气,反应速率 (增大、减小、不变).
(1)10s末L的物质的量浓度为
(2)前10s内用M表示的化学反应速率为
(3)化学方程式中x值为
(4)在恒温恒容条件,往容器中加入1mol氦气,反应速率
(5)在恒温恒压条件,往容器中加入1mol氦气,反应速率
考点:化学平衡的计算
专题:化学平衡专题
分析:结合化学平衡三段式列式计算,根据n=cV计算生成Q的物质的量,结合R的物质的量,利用物质的量之比等于化学计量数之比计算x的值;
(1)物质浓度c=
计算;
(2)依据反应速率概念计算v=
计算得到;
(3)利用物质的量之比等于化学计量数之比计算x的值;
(4)在恒温恒容条件,往容器中加入1mol氦气,总压增大,分压不变平衡不动,反应速率不变;
(5)在恒温恒压条件,往容器中加入1mol氦气,为保持恒压条件增大,压强减小,反应速率减小.
(1)物质浓度c=
| n |
| V |
(2)依据反应速率概念计算v=
| △c |
| △t |
(3)利用物质的量之比等于化学计量数之比计算x的值;
(4)在恒温恒容条件,往容器中加入1mol氦气,总压增大,分压不变平衡不动,反应速率不变;
(5)在恒温恒压条件,往容器中加入1mol氦气,为保持恒压条件增大,压强减小,反应速率减小.
解答:
解:经2min达平衡,生成2.4molR,并测得Q的浓度为0.4mol/L,Q物质的量=0.4mol/L×2L=0.8mol,物质的量之比等于化学计量数之比,0.8:2.4=x:3,计算得到x=1;
2L(g)+3M(g)?Q(g)+3R(g)
起始量(mol) 2 3 0 0
变化量(mol) 1.6 2.4 0.8 2.4
10s末(mol) 0.4 0.6 0.8 2.4
(1)10s末L的物质的量浓度=
=0.2mol/L,故答案为:0.2mol/L;
(2)前10s内用M表示的化学反应速率=
=0.12mol/L?s,故答案为:0.12mol/L?s;
(3)经2min达平衡,生成2.4molR,并测得Q的浓度为0.4mol/L,Q物质的量=0.4mol/L×2L=0.8mol,物质的量之比等于化学计量数之比,0.8:2.4=x:3,计算得到x=1,故答案为:1;
(4)在恒温恒容条件,往容器中加入1mol氦气,总压增大,分压不变平衡不动,反应速率不变,故答案为:不变;
(5)在恒温恒压条件,往容器中加入1mol氦气,为保持恒压条件增大,压强减小,反应速率减小,故答案为:减小.
2L(g)+3M(g)?Q(g)+3R(g)
起始量(mol) 2 3 0 0
变化量(mol) 1.6 2.4 0.8 2.4
10s末(mol) 0.4 0.6 0.8 2.4
(1)10s末L的物质的量浓度=
| 0.4mol |
| 2L |
(2)前10s内用M表示的化学反应速率=
| ||
| 10s |
(3)经2min达平衡,生成2.4molR,并测得Q的浓度为0.4mol/L,Q物质的量=0.4mol/L×2L=0.8mol,物质的量之比等于化学计量数之比,0.8:2.4=x:3,计算得到x=1,故答案为:1;
(4)在恒温恒容条件,往容器中加入1mol氦气,总压增大,分压不变平衡不动,反应速率不变,故答案为:不变;
(5)在恒温恒压条件,往容器中加入1mol氦气,为保持恒压条件增大,压强减小,反应速率减小,故答案为:减小.
点评:本题考查了化学平衡计算分析应用,主要是浓度、反应速率的计算应用,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
在做中和热实验测定中和热时,应使用的仪器正确的组合是( )
①天平 ②量筒 ③烧杯 ④温度计 ⑤试管 ⑥酒精灯.
①天平 ②量筒 ③烧杯 ④温度计 ⑤试管 ⑥酒精灯.
| A、①②⑤ | B、②③④ |
| C、②③⑥ | D、全部 |
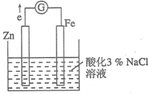 某化学兴趣小组对电化学问题进行了实验探究.利用如图装置探究金属的防护措施,实验现象是锌电极不断溶解,铁电极表面有气泡产生.
某化学兴趣小组对电化学问题进行了实验探究.利用如图装置探究金属的防护措施,实验现象是锌电极不断溶解,铁电极表面有气泡产生.
