题目内容
3.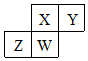 短周期元素X、Y、Z、W在元素周期表中的相对位置如右图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法错误的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如右图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法错误的是( )| A. | 原子半径:Z>W>X>Y | |
| B. | 元素X、Z的最高化合价分别与其主族序数相等 | |
| C. | 最高价氧化物对应水化物的酸性:Y>X>W | |
| D. | 最简单气态氢化物的热稳定性:Y>X>W>Z |
分析 短周期元素W的质子数是其最外层电子数的三倍,则W是P元素,根据元素在周期表中的位置关系可确定:X是N元素,Y是O元素,Z是Si元素,然后结合元素周期律来解答.
解答 解:短周期元素W的质子数是其最外层电子数的三倍,则W是P元素,根据元素在周期表中的位置关系可确定:X是N元素,Y是O元素,Z是Si元素,
A.同一周期的元素,原子序数越大,原子半径越小,不同周期的元素,原子核外电子层数越多,原子半径就越大,所以原子半径大小关系是:Z>W>X>Y,故A正确;
B.主族元素除了O和F之外,最高化合价等于主族序数,所以X、Z的最高化合价分别与其主族序数相等,故B正确;
C.元素的非金属性越强,其最高价氧化物对应的水化物的酸性越强,元素的非金属性:Y>X>W>Z,它们的最高价氧化物对应水化物的酸性:X>W>Z,但Y不存在最高价含氧酸,故C错误;
D.元素的非金属性越强,其相应的氢化物的稳定性就越强,元素的非金属性:Y>X>W>Z,所以元素的氢化物的稳定性:Y>X>W>Z,故D正确;
故选C.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意氧无正价,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )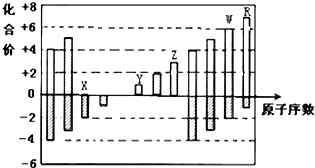

| A. | 原子半径:Z>Y>X | |
| B. | 气态氢化物的稳定性:R<W | |
| C. | Y和Z两者最高价氧化物对应的水化物能相互反应 | |
| D. | WX3和水反应形成的化合物是离子化合物 |
14.下列依据热化学方程式得出的结论正确的是( )
| A. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| B. | 氢气的燃烧热为285.5 kJ•mol-1,则水分解的热化学方程式2H2O(l)=2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| C. | 已知稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1,则浓硫酸与稀NaOH溶液反应生成1 mol水时放出的热量为57.3 kJ | |
| D. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量.则Fe(s)+S(s)=FeS(s)△H=-95.6 kJ•mol-1 |
11.某元素的一种同位素X原子的质量数为A,含N个中子,它与2H原子组成2HmX分子,在a g 2 HmX分子中含质子的物质的量是( )
| A. | $\frac{a}{A}$(A-N)mol | B. | $\frac{a}{A+2m}$(A-N+m)mol | C. | $\frac{a}{A+2m}$(A-N)mol | D. | $\frac{a}{A+m}$(A-N+m)mol |
18.某化学兴趣小组用铝片与稀硫酸反应制取氢气,以下能够加快该反应速率的是( )
①用18.4mol/L的浓硫酸代替稀硫酸 ②加热 ③改用铝粉 ④增大稀硫酸的体积 ⑤加水
⑥加入少量硫酸铜固体 ⑦加入少量硝酸钠固体.
①用18.4mol/L的浓硫酸代替稀硫酸 ②加热 ③改用铝粉 ④增大稀硫酸的体积 ⑤加水
⑥加入少量硫酸铜固体 ⑦加入少量硝酸钠固体.
| A. | ②③⑥ | B. | 全部 | C. | ①②③⑥⑦ | D. | ②③④⑥⑦ |
8.如图所示的实验操作,不能达到相应目的是( )
| A. |  干燥Cl2 | B. |  检验K2CO3中的K+ | C. |  转移溶液 | D. |  实验室制氨气 |
12.下列气体中,比氧气与血红蛋白结合能力强,能引起中毒的是( )
| A. | N2 | B. | NO | C. | CH4 | D. | NH3 |
13.c(OH-)相同的氢氧化钠溶液和氨水,分别用蒸馏水稀释至原体积的m倍和n倍,若稀释后两溶液的c(OH-)仍相同,则m和n的关系是( )
| A. | m>n | B. | m=n | C. | m<n | D. | 不能确定 |