题目内容
18.某化学兴趣小组用铝片与稀硫酸反应制取氢气,以下能够加快该反应速率的是( )①用18.4mol/L的浓硫酸代替稀硫酸 ②加热 ③改用铝粉 ④增大稀硫酸的体积 ⑤加水
⑥加入少量硫酸铜固体 ⑦加入少量硝酸钠固体.
| A. | ②③⑥ | B. | 全部 | C. | ①②③⑥⑦ | D. | ②③④⑥⑦ |
分析 根据升高温度、增大物质的接触面积、构成原电池等可加快反应速率,并注意利用浓硫酸、硝酸盐酸性条件下具有强氧化性来解答.
解答 解:①因浓硫酸具有强氧化性,则铝与浓硫酸反应生成二氧化硫,而得不到氢气,如在常温下,发生钝化反应,故错误;
②加热能使反应速率加快,故正确;
③改用铝粉,固体表面积增大,反应速率增大,故正确;
④增大稀硫酸的体积,如浓度不变,则反应速率不变,故错误;
⑤加水,溶液浓度降低,反应速率减小,故错误;
⑥加入少量硫酸铜,铝置换出铜,形成原电池反应,反应速率增大,故正确;
⑦加入少量硝酸钠固体,在酸性条件下与Al发生氧化还原反应生成NO,不生成氢气,故错误;
故选A.
点评 本题考查影响反应速率的因素,为高频考点,把握反应速率的影响因素等为解答的关键,侧重分析与应用能力的考查,注意浓硫酸、硝酸盐的性质及对化学反应速率的影响,题目难度不大.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
8.下列各组元素的原子序数中,其相应的元素原子能形成X2Y共价化合物的是( )
| A. | 11与16 | B. | 1与8 | C. | 12与17 | D. | 6与8 |
9.二氯化二硫(S2C12)分子中的各原子最外层电子数均满足8电子,易与水反应:2S2Cl2+2H2O═4HCl+SO2↑+3S↓.对该反应下列说法正确的是( )
| A. | 1molS2C12价电子数为66NA | |
| B. | 氧化产物与还原产物的物质的量之比为l:7 | |
| C. | 每生成l mol SO2转移4 NA电子 | |
| D. | 每生成48g硫单质会断裂5NA共价键 |
13.下列分子中,所有原子都满足最外层为8电子结构的是( )
| A. | BF3 | B. | PCl5 | C. | NCl3 | D. | CH4 |
3.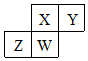 短周期元素X、Y、Z、W在元素周期表中的相对位置如右图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法错误的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如右图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法错误的是( )
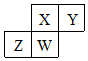 短周期元素X、Y、Z、W在元素周期表中的相对位置如右图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法错误的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如右图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法错误的是( )| A. | 原子半径:Z>W>X>Y | |
| B. | 元素X、Z的最高化合价分别与其主族序数相等 | |
| C. | 最高价氧化物对应水化物的酸性:Y>X>W | |
| D. | 最简单气态氢化物的热稳定性:Y>X>W>Z |
10.进行钠与水反应的实验,实验现象归纳表中.为了解释这些现象,请从“供选择的理由”栏中,选择适合的字母代号填入对应的空格中.
| 序号 | 实验现象 | 答案 | 供选择的理由 |
| (1) | 小刀能切割钠块 | C | A有碱(NaOH)生成 B钠密度小于水的密度,钠球表面生成气体(H2)速率不同 C钠硬度较小 D钠的熔点较低,发生放热反应 |
| (2) | 钠溶液化成闪亮的小球 | D | |
| (3) | 钠球浮在水面上,四处游动 | B | |
| (4) | 水中酚酞变红色 | A |
7.在原电池和电解池的电极上所发生的反应,同属氧化或还原的是( )
| A. | 原电池的正极和电解池的阳极所发生的反应 | |
| B. | 原电池的阳极和电解池的负极所发生的反应 | |
| C. | 原电池的负极和电解池的阳极所发生的反应 | |
| D. | 原电池的负极和电解池的阴极所发生的反应 |
8.能正确表示下列化学反应的离子方程式的是( )
| A. | 氢氧化钡溶液与硫酸的反应 OH-+H+=H2O | |
| B. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+=Ca2++2H2O | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag | |
| D. | 碳酸钙溶于稀盐酸中 CaCO3+2H+=Ca2++H2O+CO2↑ |
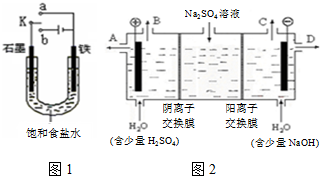
 2OH-+H2↑+Cl2↑;.
2OH-+H2↑+Cl2↑;.