题目内容
15.将单质Fe、Cu与FeCl3、FeCl2、CuCl2溶液一起放进某容器内,根据下述不同情况,填写金属或金属离子:(1)充分反应后,如果Fe有剩余,则容器内不可能有:Fe3+、Cu2+;;
(2)充分反应后,如果容器内有较多Cu2+和Cu,则容器内不可能有Fe3+、Fe.
分析 在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,向装有氯化铁溶液的烧杯中,加入一定量的Cu和Fe的混合粉末,则铁和铜都能与氯化铁溶液反应.氧化性:FeCl3>CuCl2>FeCl2,还原性Fe>Cu,Fe有剩余,则Cu没有参加反应,溶液中不存在Fe3+、Cu2+,以此解答该题.
解答 解:氧化性:FeCl3>CuCl2>FeCl2,还原性Fe>Cu,
(1)反应后铁有剩余,发生Fe+2FeCl3=3FeCl2,Fe+CuCl2=Cu+FeCl2,Fe3+、Cu2+都不能存在,故答案为:Fe3+、Cu2+;
(2)若CuCl2和Cu有剩余,由于氯化铜可氧化单质铁,则不可能有Fe,铜与铁离子反应生成亚铁离子,容器中不可能有Fe3+,故答案为:Fe3+、Fe.
点评 本题考查氧化还原反应以及铁的单质化合物的性质,题目难度不大,本题关键是把握物质的氧化性、还原性强弱判断反应的先后顺序.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
5.以石油为原料生产简单化工产品,下列说法正确的是( )
石油$\stackrel{①}{→}$分馏产品$\stackrel{②}{→}$乙烯$\stackrel{③}{→}$CH2BrCH2Br.
石油$\stackrel{①}{→}$分馏产品$\stackrel{②}{→}$乙烯$\stackrel{③}{→}$CH2BrCH2Br.
| A. | ①②过程中都只发生了物理变化 | |
| B. | 石油主要是由各种烷烃、环烷烃、芳香烃组成的混合物 | |
| C. | 石油的分馏产品中不能得到汽油、柴油 | |
| D. | ③是加成反应,产物名称是1,2-溴乙烷 |
3.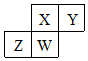 短周期元素X、Y、Z、W在元素周期表中的相对位置如右图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法错误的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如右图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法错误的是( )
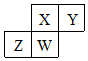 短周期元素X、Y、Z、W在元素周期表中的相对位置如右图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法错误的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如右图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法错误的是( )| A. | 原子半径:Z>W>X>Y | |
| B. | 元素X、Z的最高化合价分别与其主族序数相等 | |
| C. | 最高价氧化物对应水化物的酸性:Y>X>W | |
| D. | 最简单气态氢化物的热稳定性:Y>X>W>Z |
10.进行钠与水反应的实验,实验现象归纳表中.为了解释这些现象,请从“供选择的理由”栏中,选择适合的字母代号填入对应的空格中.
| 序号 | 实验现象 | 答案 | 供选择的理由 |
| (1) | 小刀能切割钠块 | C | A有碱(NaOH)生成 B钠密度小于水的密度,钠球表面生成气体(H2)速率不同 C钠硬度较小 D钠的熔点较低,发生放热反应 |
| (2) | 钠溶液化成闪亮的小球 | D | |
| (3) | 钠球浮在水面上,四处游动 | B | |
| (4) | 水中酚酞变红色 | A |
20.下列操作能达到预期目标的是( )
| A. | 将酒精和1 mol/L的硫酸溶液混合,迅速升温到170℃制取乙烯气体 | |
| B. | 在两支分别盛有少量苯和四氯化碳的试管中加碘水后振荡,鉴别苯和四氯化碳 | |
| C. | 酒精与碘水混合并振荡,萃取碘水中的碘 | |
| D. | 在苯中加铁粉后再加溴水并振荡,制取溴苯 |
7.在原电池和电解池的电极上所发生的反应,同属氧化或还原的是( )
| A. | 原电池的正极和电解池的阳极所发生的反应 | |
| B. | 原电池的阳极和电解池的负极所发生的反应 | |
| C. | 原电池的负极和电解池的阳极所发生的反应 | |
| D. | 原电池的负极和电解池的阴极所发生的反应 |
4.下列变化过程中,△S<0的是( )
| A. | 硫酸钠晶体溶于水中 | |
| B. | NH4HCO3(s)分解生成NH3(g)、CO2(g)和H2O(g) | |
| C. | 水结成冰 | |
| D. | 干冰升华 |
5.X、Y、Z、W、J是元素周期表前四周期中的四种常见元素,其相关信息如表:
(1)元素Y在元素周期表的位置第三周期第VIA族.
(2)元素Z的原子最外层共有17种不同运动状态的电子.
(3)W的基态原子核外电子排布式是1s22s22p63s23p63d104s1.
(4)下列表述中能证明元素Y与元素Z非金属性较强的是cdf.
a.常温下,Y的单质与Z的单质状态不同
b.等物质的量浓度的氢化物水溶液的酸性不同
c.Z的电负性大于Y
d.Z的氢化物比Y的氢化物稳定
e.在反应中,Y原子得电子数比Z原子得电子数多
f.Z元素最高价氧化物对应水化物的酸性比Y元素最高价氧化物对应水化物的酸性强
(5)J的气态氢化物中心原子的杂化方式是sp3,与该原子形成的单质分子互为等电子体的含X元素的分子式为CO.
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | M层上有2对成对电子 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
| J | J的气态氢化物与J的最高价氧化物对应的水化物可反应生成一种盐 |
(2)元素Z的原子最外层共有17种不同运动状态的电子.
(3)W的基态原子核外电子排布式是1s22s22p63s23p63d104s1.
(4)下列表述中能证明元素Y与元素Z非金属性较强的是cdf.
a.常温下,Y的单质与Z的单质状态不同
b.等物质的量浓度的氢化物水溶液的酸性不同
c.Z的电负性大于Y
d.Z的氢化物比Y的氢化物稳定
e.在反应中,Y原子得电子数比Z原子得电子数多
f.Z元素最高价氧化物对应水化物的酸性比Y元素最高价氧化物对应水化物的酸性强
(5)J的气态氢化物中心原子的杂化方式是sp3,与该原子形成的单质分子互为等电子体的含X元素的分子式为CO.
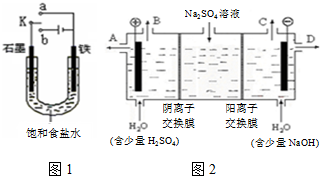
 2OH-+H2↑+Cl2↑;.
2OH-+H2↑+Cl2↑;.