题目内容
13.c(OH-)相同的氢氧化钠溶液和氨水,分别用蒸馏水稀释至原体积的m倍和n倍,若稀释后两溶液的c(OH-)仍相同,则m和n的关系是( )| A. | m>n | B. | m=n | C. | m<n | D. | 不能确定 |
分析 一水合氨是弱电解质,加水稀释有利于电离平衡正向移动,而氢氧化钠是强电解质,不存在电离平衡,以此解答该题.
解答 解:因一水合氨是弱碱,加水后反应正向进行,氨水电离度增加,加水后,氢氧根离子浓度在减小的过程中氢离子的物质的量增大,而氢氧化钠是强酸在水中完全电离,加水后,氢氧根离子浓度只是在减小,氢离子的物质的量不变,所以要使稀释后两溶液pH值相同,则氨水的体积比氢氧化钠的体积要小,就必须使m<n.
故选C.
点评 本题考查了稀释对强弱电解质的不同影响,为高频考点,侧重于学生的分析能力的考查,注意加水稀释,弱电解质的电离平衡会向右移动,题目难度不大.

练习册系列答案
相关题目
3.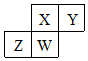 短周期元素X、Y、Z、W在元素周期表中的相对位置如右图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法错误的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如右图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法错误的是( )
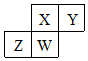 短周期元素X、Y、Z、W在元素周期表中的相对位置如右图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法错误的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如右图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法错误的是( )| A. | 原子半径:Z>W>X>Y | |
| B. | 元素X、Z的最高化合价分别与其主族序数相等 | |
| C. | 最高价氧化物对应水化物的酸性:Y>X>W | |
| D. | 最简单气态氢化物的热稳定性:Y>X>W>Z |
4.下列变化过程中,△S<0的是( )
| A. | 硫酸钠晶体溶于水中 | |
| B. | NH4HCO3(s)分解生成NH3(g)、CO2(g)和H2O(g) | |
| C. | 水结成冰 | |
| D. | 干冰升华 |
8.能正确表示下列化学反应的离子方程式的是( )
| A. | 氢氧化钡溶液与硫酸的反应 OH-+H+=H2O | |
| B. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+=Ca2++2H2O | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag | |
| D. | 碳酸钙溶于稀盐酸中 CaCO3+2H+=Ca2++H2O+CO2↑ |
18.下列说法不正确的是( )
| A. | 某炔烃经催化加氢后,得到2-甲基丁烷,该炔烃是3-甲基-1-丁炔 | |
| B. | 有机物 的命名为2,2,4,4,5-五甲基-3,3-二乙基己烷 的命名为2,2,4,4,5-五甲基-3,3-二乙基己烷 | |
| C. | 甲烷、甲醛、尿素都不存在同分异构体 | |
| D. | 某芳香烃的分子式为C10H14,它不能使溴水褪色,但可使酸性KMnO4溶液褪色,且分子结构中只有一个烷基,符合条件的烃有3种 |
5.X、Y、Z、W、J是元素周期表前四周期中的四种常见元素,其相关信息如表:
(1)元素Y在元素周期表的位置第三周期第VIA族.
(2)元素Z的原子最外层共有17种不同运动状态的电子.
(3)W的基态原子核外电子排布式是1s22s22p63s23p63d104s1.
(4)下列表述中能证明元素Y与元素Z非金属性较强的是cdf.
a.常温下,Y的单质与Z的单质状态不同
b.等物质的量浓度的氢化物水溶液的酸性不同
c.Z的电负性大于Y
d.Z的氢化物比Y的氢化物稳定
e.在反应中,Y原子得电子数比Z原子得电子数多
f.Z元素最高价氧化物对应水化物的酸性比Y元素最高价氧化物对应水化物的酸性强
(5)J的气态氢化物中心原子的杂化方式是sp3,与该原子形成的单质分子互为等电子体的含X元素的分子式为CO.
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | M层上有2对成对电子 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
| J | J的气态氢化物与J的最高价氧化物对应的水化物可反应生成一种盐 |
(2)元素Z的原子最外层共有17种不同运动状态的电子.
(3)W的基态原子核外电子排布式是1s22s22p63s23p63d104s1.
(4)下列表述中能证明元素Y与元素Z非金属性较强的是cdf.
a.常温下,Y的单质与Z的单质状态不同
b.等物质的量浓度的氢化物水溶液的酸性不同
c.Z的电负性大于Y
d.Z的氢化物比Y的氢化物稳定
e.在反应中,Y原子得电子数比Z原子得电子数多
f.Z元素最高价氧化物对应水化物的酸性比Y元素最高价氧化物对应水化物的酸性强
(5)J的气态氢化物中心原子的杂化方式是sp3,与该原子形成的单质分子互为等电子体的含X元素的分子式为CO.
2.以锌片和铜片为两极、稀硫酸为电解液组成原电池,当导线中通过2mo1电子时,下列说法正确的是( )
| A. | 锌片溶解了1mol,铜片上析出1mol氢气 | |
| B. | 两极上溶解和析出的物质的质量相等 | |
| C. | 锌片溶解了1g,铜片上析出1g氢气 | |
| D. | 电解质溶液pH不变 |
18.在含有2mol复盐NH4Al(SO4)2的溶液中加入Ba(OH)2溶液,若生成4mol沉淀,则加入的Ba(OH)2的物质的量可能为( )
| A. | 6mol | B. | 4.7mol | C. | 3mol | D. | 2.4mol |
 在如图中,甲烧杯中盛有100mL 0.50mol/L AgNO3溶液,乙烧杯中盛有100mL 0.25mol/L CuCl2溶液,A、B、C、D均为质量相同的石墨电极,如果电解一段时间后,发现A极比C极重1.9g.
在如图中,甲烧杯中盛有100mL 0.50mol/L AgNO3溶液,乙烧杯中盛有100mL 0.25mol/L CuCl2溶液,A、B、C、D均为质量相同的石墨电极,如果电解一段时间后,发现A极比C极重1.9g.