题目内容
14.下列依据热化学方程式得出的结论正确的是( )| A. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| B. | 氢气的燃烧热为285.5 kJ•mol-1,则水分解的热化学方程式2H2O(l)=2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| C. | 已知稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1,则浓硫酸与稀NaOH溶液反应生成1 mol水时放出的热量为57.3 kJ | |
| D. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量.则Fe(s)+S(s)=FeS(s)△H=-95.6 kJ•mol-1 |
分析 A、物质能量越低越稳定分析;
B、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;
C、浓硫酸的稀释过程是放热的;
D、根据参加反应的物质的量计算反应热;
解答 解:A、石墨转化为金刚石是吸热,所以石墨具有的能量小于金刚石的能量,石墨比金刚石稳定,故A错误;
B、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,所以水分解的热化学方程式:H2O(l)=H2(g)+$\frac{1}{2}$O2(g)△H=+285.5 kJ•mol-1;故B错误;
C、浓硫酸的稀释过程是放热的,浓硫酸与稀NaOH溶液反应生成1 mol水时放出的热量大于57.3 kJ,故C错误;
D、n(S)=$\frac{m}{M}$=$\frac{9.6g}{32g/mol}$=0.3mol,n(Fe)=$\frac{m}{M}$=$\frac{11.2g}{56g/mol}$=0.2mol,已知Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS,所以Fe的量不足,按照Fe计算,$\frac{0.2}{19.12}$=$\frac{0.1}{Q}$,所以1molFe反应放出热量为:95.6 kJ,所以热化学方程式为:Fe(s)+S(s)=FeS(s)△H=-95.6 kJ•mol-1,故D正确;
故选D.
点评 本题考查了燃烧热、中和热概念的分析判断,反应热的计算,热化学方程式的书写,题目难度中等,做题时注意要准确利理解概念.

练习册系列答案
相关题目
4.短周期元素X、Y、Z、M、N原子序数依次增大,有关信息如下:
(1)XY2的电子式是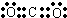 ;
;
Z2Y2中所含化学键类型是离子键和非极性共价键;(极性键、非极性键、离子键)
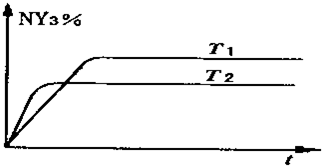
(2)①恒容条件下,一定量的NY2、Y2发生反应:2NY2(g)+Y2(g)?2NY3(g).
温度分别为T1和T2时,NY3的体积分数随时间变化如图,该反应的△H<0(填“>”“<”或“=”,下同)若T1、T2时刻反应的化学平衡常数分别为K1、K2,则K1>K2.
②恒压条件下,在该容器中充入惰性气体v(NY2)将减小(填增大或减小)
| 元素 | 有关信息 |
| X | 最外层电子数是次外层的2倍 |
| Y | 元素主要化合价为-2价 |
| Z | 其单质及化合物的焰色为黄色 |
| M | 与X同主族,其单质为半导体材料 |
| N | 其单质在Y单质中燃烧,发出明亮的蓝紫色火焰 |
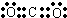 ;
;Z2Y2中所含化学键类型是离子键和非极性共价键;(极性键、非极性键、离子键)
(2)①恒容条件下,一定量的NY2、Y2发生反应:2NY2(g)+Y2(g)?2NY3(g).
温度分别为T1和T2时,NY3的体积分数随时间变化如图,该反应的△H<0(填“>”“<”或“=”,下同)若T1、T2时刻反应的化学平衡常数分别为K1、K2,则K1>K2.

②恒压条件下,在该容器中充入惰性气体v(NY2)将减小(填增大或减小)
5.以石油为原料生产简单化工产品,下列说法正确的是( )
石油$\stackrel{①}{→}$分馏产品$\stackrel{②}{→}$乙烯$\stackrel{③}{→}$CH2BrCH2Br.
石油$\stackrel{①}{→}$分馏产品$\stackrel{②}{→}$乙烯$\stackrel{③}{→}$CH2BrCH2Br.
| A. | ①②过程中都只发生了物理变化 | |
| B. | 石油主要是由各种烷烃、环烷烃、芳香烃组成的混合物 | |
| C. | 石油的分馏产品中不能得到汽油、柴油 | |
| D. | ③是加成反应,产物名称是1,2-溴乙烷 |
9.二氯化二硫(S2C12)分子中的各原子最外层电子数均满足8电子,易与水反应:2S2Cl2+2H2O═4HCl+SO2↑+3S↓.对该反应下列说法正确的是( )
| A. | 1molS2C12价电子数为66NA | |
| B. | 氧化产物与还原产物的物质的量之比为l:7 | |
| C. | 每生成l mol SO2转移4 NA电子 | |
| D. | 每生成48g硫单质会断裂5NA共价键 |
19.10mL浓度为1mol•L-1的盐酸跟过量的锌片反应,为减慢反应速率,又不影响生成氢气的总量,可采用的方法是( )
| A. | 加入少量1mol•L-1的盐酸 | B. | 加入几滴CuSO4溶液 | ||
| C. | 加入少量NaNO3溶液 | D. | 加入少量CH3COONa溶液 |
3.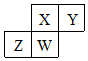 短周期元素X、Y、Z、W在元素周期表中的相对位置如右图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法错误的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如右图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法错误的是( )
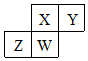 短周期元素X、Y、Z、W在元素周期表中的相对位置如右图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法错误的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如右图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法错误的是( )| A. | 原子半径:Z>W>X>Y | |
| B. | 元素X、Z的最高化合价分别与其主族序数相等 | |
| C. | 最高价氧化物对应水化物的酸性:Y>X>W | |
| D. | 最简单气态氢化物的热稳定性:Y>X>W>Z |
4.下列变化过程中,△S<0的是( )
| A. | 硫酸钠晶体溶于水中 | |
| B. | NH4HCO3(s)分解生成NH3(g)、CO2(g)和H2O(g) | |
| C. | 水结成冰 | |
| D. | 干冰升华 |
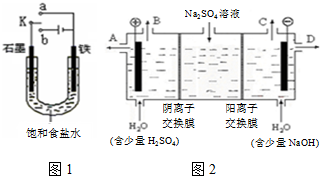
 2OH-+H2↑+Cl2↑;.
2OH-+H2↑+Cl2↑;.