题目内容
11.某元素的一种同位素X原子的质量数为A,含N个中子,它与2H原子组成2HmX分子,在a g 2 HmX分子中含质子的物质的量是( )| A. | $\frac{a}{A}$(A-N)mol | B. | $\frac{a}{A+2m}$(A-N+m)mol | C. | $\frac{a}{A+2m}$(A-N)mol | D. | $\frac{a}{A+m}$(A-N+m)mol |
分析 根据质子数=质量数-中子数计算X原子质子数,进而计算每个HmX分子含有质子数,根据n=$\frac{m}{M}$计算HmX的物质的量,结合每个分子含有质子数计算.
解答 解:某元素的一种同位素X的原子质量数为A,含N个中子,则质子数为(A-N),则每个HmX分子含有质子数为(A-N+m),ag HmX的物质的量为$\frac{ag}{(2m+A)g/mol}$=$\frac{a}{2m+A}$mol,故含有质子物质的量为$\frac{a}{2m+A}$mol×(A-N+m)=$\frac{a}{2m+A}$(A-N+m) mol,故选B.
点评 本题考查物质的量有关计算、原子结构,比较基础,属于字母型计算,一定程度上增大计算难度.

练习册系列答案
相关题目
19.10mL浓度为1mol•L-1的盐酸跟过量的锌片反应,为减慢反应速率,又不影响生成氢气的总量,可采用的方法是( )
| A. | 加入少量1mol•L-1的盐酸 | B. | 加入几滴CuSO4溶液 | ||
| C. | 加入少量NaNO3溶液 | D. | 加入少量CH3COONa溶液 |
16.固体NH5属离子化合物,它与水反应的方程式为:NH5+H2O═NH3•H2O+H2↑,它也能跟乙醇、乙酸、盐酸等发生类似的反应,并都产生氢气.下列有关NH5叙述正确的是( )
| A. | 1mol NH5中含有3NA个N-H键 | |
| B. | NH5中N元素的化合价为-5价 | |
| C. | 1mol NH5与水反应时,转移电子为NA | |
| D. | 与乙酸反应时,NH5被还原 |
3.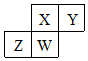 短周期元素X、Y、Z、W在元素周期表中的相对位置如右图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法错误的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如右图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法错误的是( )
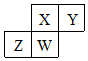 短周期元素X、Y、Z、W在元素周期表中的相对位置如右图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法错误的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如右图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法错误的是( )| A. | 原子半径:Z>W>X>Y | |
| B. | 元素X、Z的最高化合价分别与其主族序数相等 | |
| C. | 最高价氧化物对应水化物的酸性:Y>X>W | |
| D. | 最简单气态氢化物的热稳定性:Y>X>W>Z |
20.下列操作能达到预期目标的是( )
| A. | 将酒精和1 mol/L的硫酸溶液混合,迅速升温到170℃制取乙烯气体 | |
| B. | 在两支分别盛有少量苯和四氯化碳的试管中加碘水后振荡,鉴别苯和四氯化碳 | |
| C. | 酒精与碘水混合并振荡,萃取碘水中的碘 | |
| D. | 在苯中加铁粉后再加溴水并振荡,制取溴苯 |
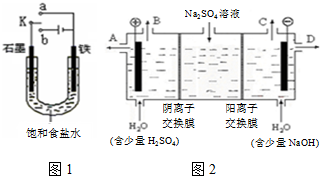
 2OH-+H2↑+Cl2↑;.
2OH-+H2↑+Cl2↑;. 在如图中,甲烧杯中盛有100mL 0.50mol/L AgNO3溶液,乙烧杯中盛有100mL 0.25mol/L CuCl2溶液,A、B、C、D均为质量相同的石墨电极,如果电解一段时间后,发现A极比C极重1.9g.
在如图中,甲烧杯中盛有100mL 0.50mol/L AgNO3溶液,乙烧杯中盛有100mL 0.25mol/L CuCl2溶液,A、B、C、D均为质量相同的石墨电极,如果电解一段时间后,发现A极比C极重1.9g.