题目内容
4.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 1.8gNH4+中含有的电子数为NA | |
| B. | 标准状况下,足量Na2O2与22.4LCO2气体充分反应,转移电子数为2NA | |
| C. | 2molSO2和1molO2在一定条件下充分反应,所得混合气体的分子数等于2NA | |
| D. | 298K时,1.0LpH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA |
分析 A.依据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$,结合1个氨根离子含有10个电子;
B.依据2mol二氧化碳与足量过氧化钠反应转移2mol电子解答;
C.二氧化硫与氧气反应为可逆反应;
D.pH=13的溶液中氢氧根离子浓度为0.1mol/L,1L该溶液中含有0.1mol氢氧根离子.
解答 解:A.1.8gNH4+中含有的电子数为$\frac{1.8g}{18g/mol}$×10×NA=NA,故A正确;
B.2mol二氧化碳与足量过氧化钠反应转移2mol电子,标准状况下22.4LCO2气体物质的量为1mol,转移电子数为1mol个数为NA,故B错误;
C.二氧化硫与氧气反应为可逆反应,不能进行到底,所以2molSO2和1molO2在一定条件下充分反应,所得混合气体的分子小于2NA,故C错误;
D.常温下,1.0L pH=13的Ba(OH)2溶液中氢氧根离子浓度为0.1mol/L,1L该溶液中含有0.1mol氢氧根离子,含有的OH-数目为0.1NA,故D错误;
故选:A.
点评 本题考查了阿伏伽德罗常数的综合应用,题目难度中等,明确标准状况下气体摩尔体积的使用条件为解答关键,注意掌握物质的量与阿伏伽德罗常数、摩尔质量、物质的量浓度等之间的关系.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
15.下列可用于鉴别以下两种化合物的试剂是( )
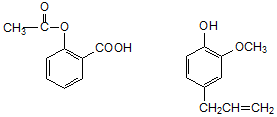

| A. | 银氨溶液 | B. | 稀溴水 | C. | 氯化铁溶液 | D. | 氢氧化钠溶液 |
12.下列事实与盐类水解无关的是( )
| A. | 氯化铝溶液蒸干后灼烧得不到无水氯化铝 | |
| B. | 氯化铁溶液常用作制印刷电路板的腐蚀剂 | |
| C. | 常用热的纯碱溶液除去油污 | |
| D. | 长期施用硫酸铵易使土壤酸化 |
19.工业上常用NaHSO3处理含Cr2O72-的废液,反应的离子方程式为:5H++Cr2O72-+3HSO3-→2Cr3++3SO42-+4H2O
下列判断错误的是( )
下列判断错误的是( )
| A. | 氧化产物是SO42- | |
| B. | 氧化剂与还原剂的物质的量之比是1:3 | |
| C. | Cr2O72-表现了氧化性 | |
| D. | 还原1molCr2O72-,电子转移3mol |
16.下列事实不能用元素周期律解释的是( )
| A. | 酸性:HClO4>H2SO4 | |
| B. | Na、Mg与水反应,Na更剧烈 | |
| C. | 气态氢化物的稳定性:HF>HCl | |
| D. | 向Na2SO3溶液中加盐酸,有气泡产生 |
 草木灰主要含有K2CO3,还含有K2SO4和KCl.某化学兴趣小组拟从草木灰中提取出钾盐晶体,并测定K2CO3的含量.
草木灰主要含有K2CO3,还含有K2SO4和KCl.某化学兴趣小组拟从草木灰中提取出钾盐晶体,并测定K2CO3的含量.