题目内容
3. 草木灰主要含有K2CO3,还含有K2SO4和KCl.某化学兴趣小组拟从草木灰中提取出钾盐晶体,并测定K2CO3的含量.
草木灰主要含有K2CO3,还含有K2SO4和KCl.某化学兴趣小组拟从草木灰中提取出钾盐晶体,并测定K2CO3的含量.(1)提取钾盐晶体的主要步骤顺序为(填字母序号):称量→A→D→C→B→冷却.
A.溶解 B.蒸发结晶 C.洗涤 D.过滤
实验A、B、C、D四步操作中均使用了玻璃棒,操作D中玻璃棒的作用是引流,防止溶液外溅,操作B用玻璃棒不断搅拌的作用是使液体受热均匀,防止液体飞溅,操作C的目的是将不溶固体表面吸附的钾盐全部转入滤液中,减小误差.
(2)为测定所得晶体中所含K2CO3的质量分数,甲同学拟采用图(Ⅰ)所示装置来测定,乙同学拟采用图(Ⅱ)所示装置来测定.试回答:
①用图(Ⅰ)装置来测定:检查该装置气密性的方法为关闭酸式滴定管活塞,用手捂热烧瓶,若注射器活塞外移,说明气密性良好.
②乙同学观察了甲同学的实验后,很受启发,并发现自己的实验设计方案会造成误差,其原因可能是CO2溶于水引起测量气体体积减小.
③丙同学经思考后,建议乙同学将图(Ⅰ)装置稍作改进,就可避免误差,请你在图(Ⅱ)上修改,画出更合理的实验装置图.
④丁同学提出将图(Ⅱ)装置中量气装置去掉,再把烧瓶换成试管,反应后也能较准确地测出样品中K2CO3的质量分数,请你分析此方案中,除称得样品的质量为m g,还需测定的两种数据是反应前装有药品的整个装置的质量、反应后整个装置的质量.烧瓶换成大试管结果更准确,原因是反应后残留的CO2替换了原有的空气,引起少许误差,试管体积小,误差更小.
分析 (1)草木灰主要含有不溶性杂质及K2CO3,还含有少量KCl、K2SO4等,测定草木灰中钾盐的含量及钾盐中K2CO3的含量,需要称量样品,溶解过滤除去不溶性杂质,蒸发结晶,过滤洗涤干燥得到晶体称量计算;
过滤操作中玻璃棒是引流作用;蒸发过程中玻璃棒起到搅拌防止局部受热液体飞溅;操作C的目的将不溶固体表面吸附的钾盐全部转入滤液中,减小误差;
(2)①根据检查装置气密性的方法分析;
②CO2溶于水引起测量气体体积减小;
③量气瓶的液体应选用不溶CO2的液体;
④丁同学用重量法测出样品中K2CO3的质量分数.
解答 解:(1)草木灰主要含有不溶性杂质及K2CO3,还含有少量KCl、K2SO4等,测定草木灰中钾盐的含量及钾盐中K2CO3的含量,需要称量样品,溶解过滤除去不溶性杂质,蒸发结晶,过滤洗涤干燥得到晶体称量计算,实验的主要步骤顺序为A,D,C,B;
实验中A、B、C、D三步操作均使用了玻璃棒,操作D是过滤,玻璃棒的作用是,倾倒液体时应用玻璃棒引流防止溶液外溅;操作B用玻璃棒不断搅动的原因是使液体受热均匀,防止液体飞溅;操作C的目的将不溶固体表面吸附的钾盐全部转入滤液中,减小误差,
故答案为:A;D;C;B;引流,防止溶液外溅;使液体受热均匀,防止液体飞溅;将不溶固体表面吸附的钾盐全部转入滤液中,减小误差;
(2)①检查装置气密性的方法是关闭酸式滴定管活塞,用手捂热烧瓶,若注射器活塞外移,说明气密性良好,
故答案为:关闭酸式滴定管活塞,用手捂热烧瓶,若注射器活塞外移,说明气密性良好;
②CO2溶于水引起测量气体体积减小,
故答案为:CO2溶于水引起测量气体体积减小;
③不溶CO2的液体有NaHCO3饱和溶液,合理的实验装置图为: ,
,
故答案为:
④丁同学用重量法测出样品中K2CO3的质量分数,需反应前装有药品的整个装置的质量、反应后整个装置的质量.把烧瓶换成试管是减少空间,即减少
残留的CO2替换了原有的空气,误差更小,
故答案为:反应前装有药品的整个装置的质量;反应后整个装置的质量;反应后残留的CO2替换了原有的空气,引起少许误差,试管体积小,误差更小.
点评 本题考查了物质性质的分析探究实验方法分析判断,实验基本操作,物质性质的分析应用,混合物成分计算质量之比的计算是解题关键,题目难度中等.

| A. | 1.8gNH4+中含有的电子数为NA | |
| B. | 标准状况下,足量Na2O2与22.4LCO2气体充分反应,转移电子数为2NA | |
| C. | 2molSO2和1molO2在一定条件下充分反应,所得混合气体的分子数等于2NA | |
| D. | 298K时,1.0LpH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA |
| A. | 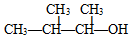 的命名为:3-甲基-2-丁醇 的命名为:3-甲基-2-丁醇 | |
| B. | 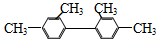 分子中至少有11个碳原子处于同一平面 分子中至少有11个碳原子处于同一平面 | |
| C. | 羟基的电子式是 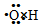 | |
| D. | 软脂酸和油酸互为同系物 |
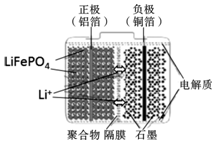 磷酸铁锂电池装置如图所示,其中正极材料橄榄石型LiFePO4通过粘合剂附着在铝箔表面,负极石墨材料附着在铜箔表面,电解质为溶解在有机溶剂中的锂盐.电池工作时的总反应为:LiFePO4+6C$?_{放电}^{充电}$ Li1-xFePO4+LixC6,则下列说法正确的是( )
磷酸铁锂电池装置如图所示,其中正极材料橄榄石型LiFePO4通过粘合剂附着在铝箔表面,负极石墨材料附着在铜箔表面,电解质为溶解在有机溶剂中的锂盐.电池工作时的总反应为:LiFePO4+6C$?_{放电}^{充电}$ Li1-xFePO4+LixC6,则下列说法正确的是( )| A. | 图中聚合物隔膜是阴离子交换膜 | |
| B. | 充电时,Li+迁移方向是“由右向左” | |
| C. | 放电时,正极的电极反应式为LiFePO4-xe-=Li1-xFePO4+xLi+ | |
| D. | 用该电池电解精炼铜,当转移电子1.25mol时能得到精铜32g,则电子利用率为80% |
(1)一份固体溶于水,加入足量BaCl2溶液,得沉淀4.46g
(2)另一份固体溶于水,与过量NaOH固体混合后充分加热,产生使湿润的红色石蕊试纸变蓝色的气体0.672L(标准状况),并得到沉淀,沉淀经洗涤、灼烧,最终获得1.6g红色固体.下列说法正确的是( )
| A. | 该固体中一定含有NH4+、Cl-、SO42-、Na+ | |
| B. | 根据以上实验,无法确定该固体中有Cl- | |
| C. | 该固体中只含有NH4+、Fe3+、SO42-、Cl- | |
| D. | 该固体中一定没有I-、CO32- |
| 实验步骤 | 实验现象 |
| ①取少量固体于试管中,加入足量蒸馏水 | 得到无色溶液和白色不溶物 |
| ②向上述试管中加入足量稀盐酸 | 有气泡冒出,白色不溶物部分溶解 |
| ③将步骤②所得物过滤,取部分滤液于试管中,向其中加入少量硝酸银溶液 | 有白色沉淀生成 |
| ④另取步骤③所得滤液少许于试管中,向其中加入足量氢氧化钠溶液 | 无明显现象 |
(1)原固体粉末中一定不含Mg2+、Fe3+(填离子符号,下同),肯定含有Ba2+、SO42-、CO32-,不能确定是否含有的阴离子是NO3-、Cl-.
(2)步骤②中白色不溶物部分溶解时发生反应的离子方程式为BaCO3+2H+=Ba2++H2O+CO2↑.
(3)若取步骤①中得到的无色溶液少许于试管中,先向其中加入过量的稀硝酸,再加入过量的硝酸钡溶液,过滤后向滤液中加入硝酸银溶液,产生白色沉淀,证明原固体粉末中一定含有Cl-(填离子符号,下同),加入过量稀硝酸的目的是排除CO32-的干扰,加入过量硝酸钡溶液的目的是排除SO42-的干扰.
①2C(s)+O2(g)═2CO(g)△H1=-220kJ/mol
②

下列推断正确的是( )
| A. | C(s)的燃烧热110 kJ/mol | |
| B. | 2H2(g)+O2(g)═2H2O(g)△H1=+480 kJ/mol | |
| C. | C(s)+H2O(g)═CO(g)+H2(g)△H1=+130 kJ/mol | |
| D. | 欲分解2 mol H2O(l),至少需要提供4×462 kJ 的热量 |
| A. | 氢气的燃烧产物是水,是理想的清洁燃料,未来可以利用蓝绿藻和微生物制备氢气 | |
| B. | 使用太阳能热水器、沼气的利用、玉米制乙醇都涉及到生物质能的利用 | |
| C. | 生物炼铜的原理是利用某些具有特殊本领的细菌把不溶性的硫化铜转化为硫酸铜 | |
| D. | 硅晶体的导电性介于导体与绝缘体之间,是一种重要的半导体材料,广泛应用于制造集成电路、太阳能电池板等 |