题目内容
15.下列可用于鉴别以下两种化合物的试剂是( )
| A. | 银氨溶液 | B. | 稀溴水 | C. | 氯化铁溶液 | D. | 氢氧化钠溶液 |
分析 前者含有酯基、羧基,具有酯和羧酸的性质,后者含有酚羟基、醚键和碳碳双键,具有酚、醚和烯烃的性质,以此解答该题.
解答 解:A.二者都不含有醛基,所以都不与银氨溶液反应,所以用银氨溶液无法鉴别,故A错误;
B.前者不含碳碳不饱和键,后者含有碳碳双键和酚羟基,所以前者和溴水不反应,后者能和溴发生加成反应而使稀溴水褪色,可以用稀溴水褪色,所以可以用稀溴水鉴别,故B正确;
C.加入氯化铁,可与酚类物质发生显色反应,可鉴别,故C正确;
D.加入氢氧化钠,前者发生水解、中和反应,后者发生中和反应,没有明显的现象,不能鉴别,故D错误.
故选BC.
点评 本题考查物质的鉴别和检验,为高频考点,把握有机物的官能团与性质及物质检验方法为解答的关键,侧重分析与实验能力的考查,注重元素化合物知识与实验的结合,题目难度不大.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
5.某同学为了测定三聚氰胺的分子式和结构简式.设计了如下实验.他查阅资料得知:三聚氰胺的相对分子质量为126,三聚氰胺在常温下为晶体,在加热条件下能与氧气发生反应生成二氧化碳、氮气和水.现有12.6g三聚氰胺晶体按图所示实验装置反应(假设三聚氰胺完全转化成产物).

(1)写出A装置中发生反应的化学方程式:2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑或2KMnO4$\frac{\underline{\;△\;}}{\;}$K2MnO4+MnO2+O2↑;
(2)C装置能不能与D装置互换?不能,(填“能”或“不能”),理由是浓硫酸吸水,碱石灰吸收二氧化碳,若互换位置,则碱石灰会同时吸收水和二氧化碳,导致实验失败
(3)当B装置中反应完全发生后,读取F中水的体积,实验操作顺序为②③①(填序号).
①读数 ②冷却至室温 ③调平E、F装置中液面
(4)测定数据如表:
经测定,收集到的气体折合成标准状况下的体积为6.72L.
①利用上述实验数据,通过计算可知三聚氰胺的实验式为CN2H2.
②三聚氰胺的分子式为C3N6H6.
③若装置中没有铜网,则对测定结果的影响是测定所得分子式的氮原子数偏大,而碳、氢原子数偏小.
(5)已知氰酸(HCN)的结构简式为H-C≡N,氰胺的结构简式为H2N一C≡N,三聚氰胺分子中每个原子的最外层电子数均为8或2,则其结构简式为 .
.

(1)写出A装置中发生反应的化学方程式:2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑或2KMnO4$\frac{\underline{\;△\;}}{\;}$K2MnO4+MnO2+O2↑;
(2)C装置能不能与D装置互换?不能,(填“能”或“不能”),理由是浓硫酸吸水,碱石灰吸收二氧化碳,若互换位置,则碱石灰会同时吸收水和二氧化碳,导致实验失败
(3)当B装置中反应完全发生后,读取F中水的体积,实验操作顺序为②③①(填序号).
①读数 ②冷却至室温 ③调平E、F装置中液面
(4)测定数据如表:
| 仪器 | C | D |
| 实验前 | 101.0g | 56.0g |
| 试验后 | 106.4g | 69.2g |
①利用上述实验数据,通过计算可知三聚氰胺的实验式为CN2H2.
②三聚氰胺的分子式为C3N6H6.
③若装置中没有铜网,则对测定结果的影响是测定所得分子式的氮原子数偏大,而碳、氢原子数偏小.
(5)已知氰酸(HCN)的结构简式为H-C≡N,氰胺的结构简式为H2N一C≡N,三聚氰胺分子中每个原子的最外层电子数均为8或2,则其结构简式为
 .
.
10.元素的电负性用来描述不同元素的原子对键合电子吸引力的大小.电负性应用:判断元素的金属性和非金属性的强弱.下表列出了同周期的几种短周期元素的部分性质
请回答下列问题:
(l)写出D元素的离子结构示意图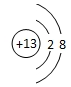 ;
;
(2)X的值应为D(填字母);
A.3.6 B.3.1 C.1.4 D.2.1
(3)分析表中数据,简述同周期元素(除惰性气体)电负性大小与原子半径的关系:同周期元素的原子半径越小,电负性越大;
(4)A、B、C三种元素形成的氢化物中,其稳定性由强到弱的顺序是:HCl>H2S>PH3(用化学式表示)
(5)A、D最高价氧化物对应水化物相互反应的化学方程式:Al(OH)3+3HClO4═Al(ClO4)3+3H2O.
请回答下列问题:
| 元素符号 | A | B | C | D | E |
| 电负性 | 3.0 | 2.5 | X | 1.5 | 0.9 |
| 原子半径(单位nm) | 0.099 | 0.102 | 0.110 | 0.143 | 0.186 |
| 主要化合价 | -1,+7 | -2,+6 | -3,+5 | +3 | +1 |
 ;
;(2)X的值应为D(填字母);
A.3.6 B.3.1 C.1.4 D.2.1
(3)分析表中数据,简述同周期元素(除惰性气体)电负性大小与原子半径的关系:同周期元素的原子半径越小,电负性越大;
(4)A、B、C三种元素形成的氢化物中,其稳定性由强到弱的顺序是:HCl>H2S>PH3(用化学式表示)
(5)A、D最高价氧化物对应水化物相互反应的化学方程式:Al(OH)3+3HClO4═Al(ClO4)3+3H2O.
20.下列实验或生产能达到目的是( )
| A. | 电解熔融的AlCl3生产铝单质 | |
| B. | 将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl2 | |
| C. | 用Ba(OH)2溶液可鉴别NaCl、AlCl3、NH4Cl、Na2SO4四种溶液 | |
| D. | 用分液漏斗从食醋中分离出乙酸 |
7.下列各组澄清溶液中离子能大量共存,且加入(或滴入)X试剂后发生反应的离子方 程式书写正确的是( )
| 选项 | 离子组 | X试剂 | 离子方程式 |
| A | K+、Na+、ClO-、SO42- | 少量SO2 | SO2+ClO-+H2O═SO42-+Cl-+2H+ |
| B | NH4+、Fe3+、Br-、SO42- | 过量H2S | 2Fe3++H2S═2Fe2++S↓+2H+ |
| C | NH4+、Na+、Fe3+、[Al(OH)4]- | 过量铜粉 | 2Fe3++Cu═2Fe2++Cu2+ |
| D | K+、Na+、HCO3-、Al3+ | 少量HCl | H++HCO3-═CO2↑+H2O |
| A. | A | B. | B | C. | C | D. | D |
4.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1.8gNH4+中含有的电子数为NA | |
| B. | 标准状况下,足量Na2O2与22.4LCO2气体充分反应,转移电子数为2NA | |
| C. | 2molSO2和1molO2在一定条件下充分反应,所得混合气体的分子数等于2NA | |
| D. | 298K时,1.0LpH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA |
15.有一固体粉末可能含有下列离子中的几种:K+、Mg2+、Fe3+、Ba2+、NO3-、CO32-、Cl-、SO42-.某小组同学为了确定其组成进行了如下实验:
由此判断:
(1)原固体粉末中一定不含Mg2+、Fe3+(填离子符号,下同),肯定含有Ba2+、SO42-、CO32-,不能确定是否含有的阴离子是NO3-、Cl-.
(2)步骤②中白色不溶物部分溶解时发生反应的离子方程式为BaCO3+2H+=Ba2++H2O+CO2↑.
(3)若取步骤①中得到的无色溶液少许于试管中,先向其中加入过量的稀硝酸,再加入过量的硝酸钡溶液,过滤后向滤液中加入硝酸银溶液,产生白色沉淀,证明原固体粉末中一定含有Cl-(填离子符号,下同),加入过量稀硝酸的目的是排除CO32-的干扰,加入过量硝酸钡溶液的目的是排除SO42-的干扰.
| 实验步骤 | 实验现象 |
| ①取少量固体于试管中,加入足量蒸馏水 | 得到无色溶液和白色不溶物 |
| ②向上述试管中加入足量稀盐酸 | 有气泡冒出,白色不溶物部分溶解 |
| ③将步骤②所得物过滤,取部分滤液于试管中,向其中加入少量硝酸银溶液 | 有白色沉淀生成 |
| ④另取步骤③所得滤液少许于试管中,向其中加入足量氢氧化钠溶液 | 无明显现象 |
(1)原固体粉末中一定不含Mg2+、Fe3+(填离子符号,下同),肯定含有Ba2+、SO42-、CO32-,不能确定是否含有的阴离子是NO3-、Cl-.
(2)步骤②中白色不溶物部分溶解时发生反应的离子方程式为BaCO3+2H+=Ba2++H2O+CO2↑.
(3)若取步骤①中得到的无色溶液少许于试管中,先向其中加入过量的稀硝酸,再加入过量的硝酸钡溶液,过滤后向滤液中加入硝酸银溶液,产生白色沉淀,证明原固体粉末中一定含有Cl-(填离子符号,下同),加入过量稀硝酸的目的是排除CO32-的干扰,加入过量硝酸钡溶液的目的是排除SO42-的干扰.
 .
.