题目内容
17.设NA 为阿伏加德罗常数的值,下列说法正确的是( )| A. | 1L 1 mol•L-1的Na2CO3 溶液中含有的阴离子数目大于NA | |
| B. | 标准状况下,2.24LCCl4中含有共价键总数为0.4NA | |
| C. | 常温常压下,18g D2O的原子总数为3NA | |
| D. | 7.1g Cl2与足量的Fe反应,转移电子数目为0.3NA |
分析 A.碳酸根离子部分水解生成氢氧根离子和碳酸氢根离子,导致溶液中阴离子数目增多;
B.气体摩尔体积使用对象为气体;
C.质量转换为物质的量,结合1个D2O含有3个原子解答;
D.A.1mol氯气失去2mol电子.
解答 解:A.常温下,1L0.1mol•L-1 Na2CO3溶液中含有溶质碳酸钠0.1mol,由于碳酸根离子部分水解,导致溶液中阴离子大于0.1mol,溶液中阴离子数目之和大于0.1NA,故A正确;
B.标况下四氯化碳为液体,不能使用气体摩尔体积,故B错误;
C.常温常压下,18g D2O的物质的量n=$\frac{18g}{20g/mol}$=0.9mol,的原子总数为2.7NA,故C错误;
D.7.1gCl2的物质的量是0.1mol,失去电子数目为0.2NA,故D错误;
故选:A.
点评 本题考查阿伏加德罗常数的有关计算和判断,注意明确标况下四氯化碳不是气体,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系,题目难度中等.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
7.电解质量分数为5.2%的NaOH溶液1L(密度为1.06g/cm3),用铂作电极电解,当溶液中NaOH的质量分数改变了1.0% 时停止电解,此时溶液中符合下表关系的是( )
| NaOH的质量分数 | 阳极析出物质的质量/g | 阴极析出物质的质量/g | |
| A | 6.2% | 19 | 152 |
| B | 6.2% | 152 | 19 |
| C | 4.2% | 1.2 | 9.4 |
| D | 4.2% | 9.4 | 1.2 |
| A. | A | B. | B | C. | C | D. | D |
5.S-诱抗素可保证盆栽鲜花盛开,其分子结构如图,下列说法正确的是( )


| A. | 该物质的分子式为C15H22O4 | |
| B. | 该物质环上的二氯代物共有3种 | |
| C. | 1mol该物质最多能与2 mol NaOH完全反应 | |
| D. | 该物质能发生取代、加成、氧化等反应 |
12.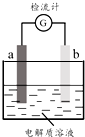 30℃时,利用图装置进行实验,结果记录如下表所示:
30℃时,利用图装置进行实验,结果记录如下表所示:
下列说法不正确的是( )
 30℃时,利用图装置进行实验,结果记录如下表所示:
30℃时,利用图装置进行实验,结果记录如下表所示:| 实验 | a电极 | b电极 | 电解质溶液 | 现象 |
| I | Cu | Zn | 稀H2SO4 | 检流计指针向左偏转 |
| Ⅱ | Fe | Al | 稀H2SO4 | 检流计指针向左偏转 |
| Ⅲ | Fe | Al | 浓H2SO4 | 检流计指针先向左偏转,后逐渐归零,a电极表面逐渐变黑,b电极表面逐渐变白 |
| Ⅳ | Fe | Al | 浓HNO3 | 检流计指针迅速向右偏转,a电极逐渐溶解,b电极表面逐渐变白 |
| A. | Ⅱ中Al为负极,其电极反应是:Al-3e-═Al3+ | |
| B. | Ⅱ中的现象说明Fe和Al表面形成致密的氧化膜,阻止了电极反应的进行 | |
| C. | Ⅳ中Fe为负极,发生了氧化反应 | |
| D. | 上述实验表明:相同条件下,Fe在浓HNO3中更稳定,Al在浓H2SO4中更稳定 |
2.下列说法正确的是( )
| A. | 蔗糖在人体内水解的最终产物是葡萄糖 | |
| B. | 蔬菜水果属于碱性食物,对人体健康有益 | |
| C. | 为了防止蛋白质发生盐析,疫苗等生物制剂要冷藏 | |
| D. | 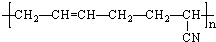 由CH2=CH2与CH2=CH-CN加聚而成 由CH2=CH2与CH2=CH-CN加聚而成 |
9.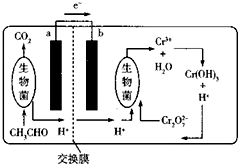 如图所示的微生物燃料电池在净化废水的同时能回收能源或得到有价值的化学产品.下列有关说法不正确的是( )
如图所示的微生物燃料电池在净化废水的同时能回收能源或得到有价值的化学产品.下列有关说法不正确的是( )
 如图所示的微生物燃料电池在净化废水的同时能回收能源或得到有价值的化学产品.下列有关说法不正确的是( )
如图所示的微生物燃料电池在净化废水的同时能回收能源或得到有价值的化学产品.下列有关说法不正确的是( )| A. | b极为正极,发生还原反应 | |
| B. | 负极的电极反应式为CH3CHO-10e-+3H2O═2CO2↑+10H+ | |
| C. | 理论上处理l mol Cr2O72-时有l4mool H+从交换膜左侧向右侧迁移 | |
| D. | 放电时,交换膜右侧生物菌周围溶液的pH增大 |
6.我国磷矿储量占世界第二位,主要矿物为磷灰石[(Ca3(PO4)2)].下图是生产化肥磷铵[(NH4)3PO4]并联产水泥的工艺流程.

(1)操作a的名称过滤,实验室中进行此操作时用到的玻璃仪器有漏斗、玻璃棒、烧杯.
(2)在实验室中操作b包括蒸发浓缩、冷却结晶.
(3)干燥机中发生反应的化学方程式为2CaSO4•2H2O+C$\frac{\underline{\;高温\;}}{\;}$2CaO+2SO2+CO2+4H2O.
(4)水泥常用做建筑材料,是利用了水泥的水硬性性质.
(5)SO2的催化氧化反应为2SO2(g)十O2(g)?2SO3(g).实验测得压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为SO2:7%,O2:11%,N2:82%).
①实际生产中,SO2的催化氧化反应是在常压、400℃~500℃条件下进行.采用常压的主要原因是常压下SO2的转化率已经很高,且增大压强时SO2的转化率提高不多,但成本增加较多;该反应化学平衡常数大小关系是:K(400℃)> K(500℃)(填“>”、“<”或“=”).
②催化氧化时使用热交换器的原因是移去反应中放出的热量,使反应后的气体降温并预热未反应的气体.
(6)制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾.下列能用于测定硫酸尾气中SO2含量的试剂组是BC.(填写相应字母)
A.NaOH溶液、酚酞试液 B.KMnO4溶液、稀H2SO4 C.碘水、淀粉溶液 D.氨水、酚酞试液.

(1)操作a的名称过滤,实验室中进行此操作时用到的玻璃仪器有漏斗、玻璃棒、烧杯.
(2)在实验室中操作b包括蒸发浓缩、冷却结晶.
(3)干燥机中发生反应的化学方程式为2CaSO4•2H2O+C$\frac{\underline{\;高温\;}}{\;}$2CaO+2SO2+CO2+4H2O.
(4)水泥常用做建筑材料,是利用了水泥的水硬性性质.
(5)SO2的催化氧化反应为2SO2(g)十O2(g)?2SO3(g).实验测得压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为SO2:7%,O2:11%,N2:82%).
 | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
②催化氧化时使用热交换器的原因是移去反应中放出的热量,使反应后的气体降温并预热未反应的气体.
(6)制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾.下列能用于测定硫酸尾气中SO2含量的试剂组是BC.(填写相应字母)
A.NaOH溶液、酚酞试液 B.KMnO4溶液、稀H2SO4 C.碘水、淀粉溶液 D.氨水、酚酞试液.
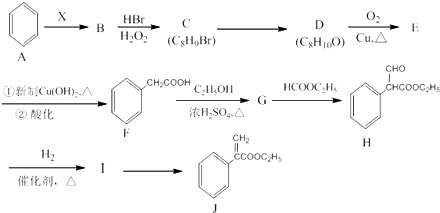
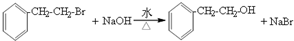 .
.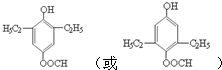 (任写一种即可).
(任写一种即可).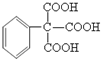 的合成路线流程图(无机试剂任选).
的合成路线流程图(无机试剂任选).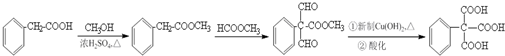 .
.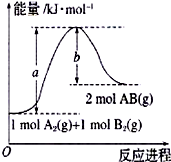 (1)已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,该反应的热化学方程式为A2(g)+B2(g)=2AB(g)△H=(a-b)kJ/mol.
(1)已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,该反应的热化学方程式为A2(g)+B2(g)=2AB(g)△H=(a-b)kJ/mol.