题目内容
7.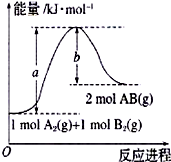 (1)已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,该反应的热化学方程式为A2(g)+B2(g)=2AB(g)△H=(a-b)kJ/mol.
(1)已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,该反应的热化学方程式为A2(g)+B2(g)=2AB(g)△H=(a-b)kJ/mol.(2)下列反应一定属于吸热反应的是②④⑤(填序号)
①氢气的燃烧;②碳酸钙分解;③锌和硫酸生成氢气的反应;④Ba(OH)2•8H2O与NH4Cl反应;⑤碳和水蒸气生成氢气和一氧化碳的反应;⑥酸碱中和反应;⑦需要加热的反应.
(3)已知2SO2(g)+O2(g)?2SO3(g)△H=-196.64kJ•mol-1.在一定温度下,向一固定容积的密闭容器中通入2molSO2和1molO2,达到平衡时放出热量为Q1kJ;在同样条件下,向该容器中通入2molSO3,达到平衡时吸收的热量为Q2kJ,则Q1和Q2的关系为Q1+Q2=196.64.
分析 (1)反应热等于反应产物具有的能量和反应物具有的能量之差;
(2)常见的放热反应有:所有的物质燃烧、所有金属与酸或与水、所有中和反应、绝大多数化合反应、铝热反应;
常见的吸热反应有:绝大数分解反应、个别的化合反应(如C和CO2)、工业制水煤气、碳(一氧化碳、氢气)还原金属氧化物、某些复分解(如铵盐和强碱).
(3)向一固定容积的密闭容器中通入2molSO2和1molO2,和向该容器中通入2molSO3,建立的平衡是等效的.
解答 解:(1)该反应的反应热焓变等于反应产物具有的能量和反应物具有的能量之差,即△H=(a-b)kJ/mol,热化学方程式为:A2(g)+B2(g)=2AB(g)△H=(a-b)kJ/mol,故答案为:A2(g)+B2(g)=2AB(g)△H=(a-b)kJ/mol;
(2)①氢气的燃烧属于放热反应,故错误;
②碳酸钙分解的反应属于吸热反应,故正确;
③锌和硫酸生成氢气的反应是放热反应,故错误;
④Ba(OH)2•8H2O与NH4Cl反应是吸热反应,故正确;
⑤碳和水蒸气生成氢气和一氧化碳的反应是吸热反应,故正确;
⑥酸碱中和反应是放热反应,故错误;
⑦需要加热的反应.有的属于放热反应,有的属于吸热反应,故错误.
故选②④⑤;
(3)向一固定容积的密闭容器中通入2molSO2和1molO2和向该容器中通入2molSO3,建立的平衡是等效的,Q1+Q2=196.64,
故答案为:Q1+Q2=196.64.
点评 本题考查反应热的计算的热化学方程式的书写知识,题目难度中等.

练习册系列答案
相关题目
17.设NA 为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1L 1 mol•L-1的Na2CO3 溶液中含有的阴离子数目大于NA | |
| B. | 标准状况下,2.24LCCl4中含有共价键总数为0.4NA | |
| C. | 常温常压下,18g D2O的原子总数为3NA | |
| D. | 7.1g Cl2与足量的Fe反应,转移电子数目为0.3NA |
18.化学与生活、生产密切相关.下列叙述错误的是( )
| A. | 过氧化钠可用作呼吸面具中的供氧剂 | |
| B. | 向海水中加净水剂明矾可使海水淡化 | |
| C. | 使用含有氯化钙的融雪剂会加速桥梁的腐蚀 | |
| D. | 服用抗氧剂维生素C有利于人体对铁元素的吸收 |
15.乙炔气经CaCl2等净化处理后,在氮气氛中可催化聚合为聚乙炔,有关表示错误的是( )
| A. | 质子数与中子数均为20的钙原子:2040Ca | |
| B. | 氮分子的电子式::N:::N: | |
| C. | 氯离子(Cl-)的结构示意图: | |
| D. | 聚乙炔的结构简式: |
2.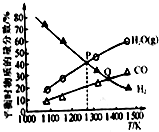 反应MoS2(s)+2Na2CO3(s)+4H2(g)?Mo(s)+2CO(g)+4H2O(g)+2Na2S(s),可用于由辉钼精矿制取钼,在2L的密闭容器中:加入0.1mol MoS2、0.2mol Na2CO3和0.4mol H2(固体体积忽略不计),测得在不同温度达到平衡时各气体的物质的量分数关系如图所示.下列说法正确的是( )
反应MoS2(s)+2Na2CO3(s)+4H2(g)?Mo(s)+2CO(g)+4H2O(g)+2Na2S(s),可用于由辉钼精矿制取钼,在2L的密闭容器中:加入0.1mol MoS2、0.2mol Na2CO3和0.4mol H2(固体体积忽略不计),测得在不同温度达到平衡时各气体的物质的量分数关系如图所示.下列说法正确的是( )
 反应MoS2(s)+2Na2CO3(s)+4H2(g)?Mo(s)+2CO(g)+4H2O(g)+2Na2S(s),可用于由辉钼精矿制取钼,在2L的密闭容器中:加入0.1mol MoS2、0.2mol Na2CO3和0.4mol H2(固体体积忽略不计),测得在不同温度达到平衡时各气体的物质的量分数关系如图所示.下列说法正确的是( )
反应MoS2(s)+2Na2CO3(s)+4H2(g)?Mo(s)+2CO(g)+4H2O(g)+2Na2S(s),可用于由辉钼精矿制取钼,在2L的密闭容器中:加入0.1mol MoS2、0.2mol Na2CO3和0.4mol H2(固体体积忽略不计),测得在不同温度达到平衡时各气体的物质的量分数关系如图所示.下列说法正确的是( )| A. | 容器内的总压:P点<Q点 | |
| B. | 正反应速率:v(Q)<v(P) | |
| C. | P点对应温度时,H2的平衡转化率为40% | |
| D. | P点对应温度的平衡常数的值为2.5×10-3 |
12.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 7.8gNa2S晶体中含有的S2-数目小于0.1NA | |
| B. | 1.68g铁与足量水蒸气反应,转移的电子数目为0.09NA | |
| C. | 11g由31H和168O组成的超重水中,含有的中子数目为5NA | |
| D. | 与17gH2O2所含非极性键数目相同的N2H4的分子数目为0.5NA |
7.某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失快慢的方法,研究影响反应速率的因素.实验条件作如下限定:
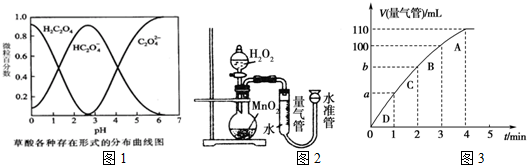
所用酸性KMnO4溶液的浓度可选择0.010mol•L-1、0.0010mol•L-1,催化剂的用量可选择0,.5g、0g,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液(0.10mol•L-1)的用量均为2mL.
(1)已知草酸溶液中各种微粒存在形式的分布曲线图如图1,请写出KMnO4酸性溶液与H2C2O4溶液反应的离子方程式2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
(2)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
(3)某同学对实验①和②分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
①实验Ⅱ中用KMnO4的浓度变化来表示的平均反应速率为1.0×10-4mol•L-1•min-1(忽略混合前后溶液的体积变化).
②该同学分析上述数据后得出“当其他条件相同的情况下,酸性KMnO4溶液的浓度越小,所需要的时间就越短,亦即其反应速率越快”的结论,
你认为是否正确否(填“是”或“否”).他认为不用经过计算,直接根据表中褪色时间的长短就可以判断浓度大小与反应速率的关系,你认为是否可行否(填“是”或“否”),若不可行(若认为可行则不填),请设计可以直接通过观察褪色时间的长短来判断的改进方案:取过量的体积相同、浓度不同的草酸溶液,分别同时与体积相同、浓度相同的酸性高锰酸钾溶液反应.
(4)该反应的催化剂选择MnCl2还是MnSO4并简述选择的理由:MnSO4,如选用MnCl2,则酸性高锰酸钾会与Cl-反应,而且引入了Cl-无法证明是Mn2+起了催化作用.
(5)化学催化剂有很多,在生产和科技领域起到重大作用.探究小组又利用乙装置探究MnO2对H2O2分解的催化效果.将50mL H2O2一次性加入盛有0.10mol MnO2粉末的烧瓶中,测得标准状况下由量气管读出气体的体积[V(量气管)/mL]和时间(t/min)的关系如图3所示.
①实验时放出气体的总体积是110 mL.
②b小于(填“大于”“小于”或“等于”)90mL.

所用酸性KMnO4溶液的浓度可选择0.010mol•L-1、0.0010mol•L-1,催化剂的用量可选择0,.5g、0g,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液(0.10mol•L-1)的用量均为2mL.
(1)已知草酸溶液中各种微粒存在形式的分布曲线图如图1,请写出KMnO4酸性溶液与H2C2O4溶液反应的离子方程式2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
(2)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 催化剂的用量/g | 酸性KMnO4溶液的浓度/mol•L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.010 | a.实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; b.实验①和③探究温度对反应速率的影响; c.实验①和④探究催化剂对反应速率的影响. |
| ② | ||||
| ③ | 0.010 | |||
| ④ |
| 实验编号 | 溶液褪色所需时间 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| Ⅰ | 14.0 | 13.0 | 11.0 |
| Ⅱ | 6.5 | 6.7 | 6.8 |
①实验Ⅱ中用KMnO4的浓度变化来表示的平均反应速率为1.0×10-4mol•L-1•min-1(忽略混合前后溶液的体积变化).
②该同学分析上述数据后得出“当其他条件相同的情况下,酸性KMnO4溶液的浓度越小,所需要的时间就越短,亦即其反应速率越快”的结论,
你认为是否正确否(填“是”或“否”).他认为不用经过计算,直接根据表中褪色时间的长短就可以判断浓度大小与反应速率的关系,你认为是否可行否(填“是”或“否”),若不可行(若认为可行则不填),请设计可以直接通过观察褪色时间的长短来判断的改进方案:取过量的体积相同、浓度不同的草酸溶液,分别同时与体积相同、浓度相同的酸性高锰酸钾溶液反应.
(4)该反应的催化剂选择MnCl2还是MnSO4并简述选择的理由:MnSO4,如选用MnCl2,则酸性高锰酸钾会与Cl-反应,而且引入了Cl-无法证明是Mn2+起了催化作用.
(5)化学催化剂有很多,在生产和科技领域起到重大作用.探究小组又利用乙装置探究MnO2对H2O2分解的催化效果.将50mL H2O2一次性加入盛有0.10mol MnO2粉末的烧瓶中,测得标准状况下由量气管读出气体的体积[V(量气管)/mL]和时间(t/min)的关系如图3所示.
①实验时放出气体的总体积是110 mL.
②b小于(填“大于”“小于”或“等于”)90mL.
5.下列说法中,可以说明恒容密闭容器中的反应:P(g)+Q(g)?R(g)+S(g)在恒温下已达平衡状态的是( )
| A. | 反应容器内压强不随时间变化 | |
| B. | P和S的生成速率相等 | |
| C. | 反应容器内P、Q、R、S四者物质的量浓度为1:1:1:1 | |
| D. | 反应容器内总物质的量不随时间而变化 |
 如图为原电池装置示意图:
如图为原电池装置示意图: