题目内容
6.我国磷矿储量占世界第二位,主要矿物为磷灰石[(Ca3(PO4)2)].下图是生产化肥磷铵[(NH4)3PO4]并联产水泥的工艺流程.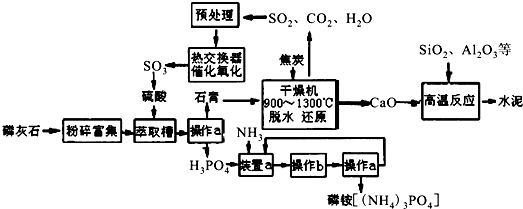
(1)操作a的名称过滤,实验室中进行此操作时用到的玻璃仪器有漏斗、玻璃棒、烧杯.
(2)在实验室中操作b包括蒸发浓缩、冷却结晶.
(3)干燥机中发生反应的化学方程式为2CaSO4•2H2O+C$\frac{\underline{\;高温\;}}{\;}$2CaO+2SO2+CO2+4H2O.
(4)水泥常用做建筑材料,是利用了水泥的水硬性性质.
(5)SO2的催化氧化反应为2SO2(g)十O2(g)?2SO3(g).实验测得压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为SO2:7%,O2:11%,N2:82%).
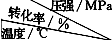 | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
②催化氧化时使用热交换器的原因是移去反应中放出的热量,使反应后的气体降温并预热未反应的气体.
(6)制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾.下列能用于测定硫酸尾气中SO2含量的试剂组是BC.(填写相应字母)
A.NaOH溶液、酚酞试液 B.KMnO4溶液、稀H2SO4 C.碘水、淀粉溶液 D.氨水、酚酞试液.
分析 磷灰石粉碎富集后,在萃取槽中用硫酸酸化得到硫酸钙与磷酸,过滤分离得到石膏与磷酸.装置a中磷酸与氨气发生反应,可以生成(NH4)3PO4、(NH4)2HPO4、NH4H2PO4,操作b是由溶液中析出晶体,应萃取蒸发浓缩、冷却结晶等操作,铵盐受热容易分解,在结晶时应采用低温蒸发结晶.在经过过滤分离得到磷酸铵,分离得到滤液进行循环利用.石膏在干燥机中脱水、再还原反应得到二氧化碳、二氧化硫、CaO等气体,气体处理后在热交换器中发生催化氧化得到三氧化硫,三氧化硫转化为硫酸,再循环利用.CaO与二氧化硫、氧化铝等反应得到水泥.
(1)操作a是把固体与液体分开,应为过滤;过滤需要烧杯、漏斗、玻璃棒、铁架台(含铁圈)、滤纸等;(2)操作b是由溶液中析出晶体,应萃取蒸发浓缩、冷却结晶等操作,铵盐受热容易分解,在结晶时应采用低温蒸发结晶;
(3)碳与石膏在干燥机内发生反应生成CaO、二氧化硫、二氧化碳与水;
(4)水泥常用做建筑材料,是利用了水泥的水硬性;
(5)①常压下SO2的转化率已经很高,且增大压强时SO2的转化率提高不多,但成本增加较多;
压强一定时,温度越高二氧化硫的转化率越低,说明升高温度平衡向逆反应方向移动;
②移去反应中放出的热量,使反应后的气体降温并预热未反应的气体;
(6)SO2、微量的SO3和酸雾都能与氢氧化钠、氨水反应,不能测定二氧化硫的含量,利用SO2的还原性采用滴定法测定其含量,可以用氧化剂酸性KMnO4溶液、碘水等氧化.
解答 解:磷灰石粉碎富集后,在萃取槽中用硫酸酸化得到硫酸钙与磷酸,过滤分离得到石膏与磷酸.装置a中磷酸与氨气发生反应,可以生成(NH4)3PO4、(NH4)2HPO4、NH4H2PO4,操作b是由溶液中析出晶体,应萃取蒸发浓缩、冷却结晶等操作,铵盐受热容易分解,在结晶时应采用低温蒸发结晶.在经过过滤分离得到磷酸铵,分离得到滤液进行循环利用.石膏在干燥机中脱水、再还原反应得到二氧化碳、二氧化硫、CaO等气体,气体处理后在热交换器中发生催化氧化得到三氧化硫,三氧化硫转化为硫酸,再循环利用.CaO与二氧化硫、氧化铝等反应得到水泥.
(1)操作a是分离固体和液体,采取过滤操作;过滤需要盛放药品的烧杯、过滤的漏斗、引流作用的玻璃棒、固定漏斗的铁架台(含铁圈)、滤纸等;
故答案为:过滤;漏斗、玻璃棒、烧杯;
(2)操作b是由溶液中析出晶体,应萃取蒸发浓缩、冷却结晶等操作,铵盐受热容易分解,在结晶时应采用低温蒸发结晶,
故答案为:蒸发浓缩;
(3)碳与石膏在干燥机内发生反应生成CaO、二氧化硫、二氧化碳与水,反应方程式为:2CaSO4•2H2O+C$\frac{\underline{\;高温\;}}{\;}$2CaO+2SO2↑+CO2↑+4 H2O,
故答案为:2CaSO4•2H2O+C$\frac{\underline{\;高温\;}}{\;}$2CaO+2SO2↑+CO2↑+4H2O;
(4)水泥常用做建筑材料,是利用了水泥的水硬性,
故答案为:水硬性;
(5)①常压下SO2的转化率已经很高,且增大压强时SO2的转化率提高不多,但成本增加较多,故选择常压;
压强一定时,温度越高二氧化硫的转化率越低,说明升高温度平衡向逆反应方向移动,升高温度平衡常数减小,即K(400℃)>K(500℃),
故答案为:常压下SO2的转化率已经很高,且增大压强时SO2的转化率提高不多,但成本增加较多;>;
②催化氧化时使用热交换器的原因是:移去反应中放出的热量,使反应后的气体降温并预热未反应的气体,
故答案为:移去反应中放出的热量,使反应后的气体降温并预热未反应的气体;
(6)A.NaOH溶液与SO2、微量的SO3和酸雾反应,测量的SO2含量偏高,故A错误;
B.硫酸尾气中只有SO2能被酸性KMnO4溶液氧化,溶液颜色由紫红色变为无色,根据KMnO4溶液的体积结合方程式计算SO2的含量,故B正确;
C.硫酸尾气中只有SO2能被碘水氧化,溶液颜色由蓝色变为无色,根据碘水溶液的体积结合方程式计算SO2的含量,故C正确;
D.氨水与SO2、微量的SO3和酸雾反应,测量的SO2含量偏高,故D错误.
故选BC.
点评 本题考查制备方案设计工艺流程,涉及物质的分离提纯、基本操作、实验条件的选择、平衡常数影响因素、物质含量测定等,是对基础知识的综合应用,难度中等.

 今有甲、乙、丙、丁、戊5种物质,在一定条件下它们能按如图方式进行转化:其推断正确的是( )
今有甲、乙、丙、丁、戊5种物质,在一定条件下它们能按如图方式进行转化:其推断正确的是( )| 选项 | 甲 | 乙 | 丙 | 丁 | 戊 |
| A | NH3 | O2 | NO | H2O | NO2 |
| B | C | H2O | CO | H2 | CH3OH |
| C | Mg | CO2 | C | MgO | CO |
| D | FeBr2 | Cl2 | FeCl2 | Br2 | FeCl3 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 1L 1 mol•L-1的Na2CO3 溶液中含有的阴离子数目大于NA | |
| B. | 标准状况下,2.24LCCl4中含有共价键总数为0.4NA | |
| C. | 常温常压下,18g D2O的原子总数为3NA | |
| D. | 7.1g Cl2与足量的Fe反应,转移电子数目为0.3NA |
| A. | 使用合成聚碳酸酯可降解塑料,可以减少“白色污染” | |
| B. | 用蘸有浓氨水的棉棒可以检验输送氯气的管道是否漏气 | |
| C. | 农作物秸秆处理起来麻烦,利用价值低,适于就地露天焚烧 | |
| D. | 推广矿物燃料脱硫脱硝技术,能有效减少二氧化硫和氮氧化物的排放 |
 ,能用该结构简式表示的X的同分异构体共有(不考虑立体异构)( )
,能用该结构简式表示的X的同分异构体共有(不考虑立体异构)( )| A. | 12种 | B. | 16种 | C. | 20种 | D. | 24种 |
| A. | 过氧化钠可用作呼吸面具中的供氧剂 | |
| B. | 向海水中加净水剂明矾可使海水淡化 | |
| C. | 使用含有氯化钙的融雪剂会加速桥梁的腐蚀 | |
| D. | 服用抗氧剂维生素C有利于人体对铁元素的吸收 |
| A. | 质子数与中子数均为20的钙原子:2040Ca | |
| B. | 氮分子的电子式::N:::N: | |
| C. | 氯离子(Cl-)的结构示意图: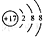 | |
| D. | 聚乙炔的结构简式: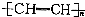 |
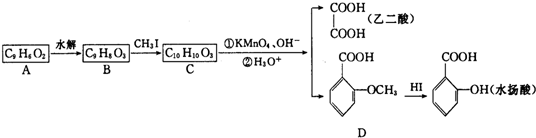
 .
.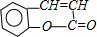 +H2O$\stackrel{酸}{→}$
+H2O$\stackrel{酸}{→}$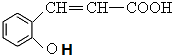 .
.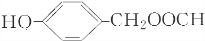 、
、 .
.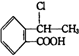 合成
合成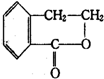 (其他无机原料自选,用反应流程图表示,并注明反应条件).示例:原料$→_{条件}^{试剂}$…产物.
(其他无机原料自选,用反应流程图表示,并注明反应条件).示例:原料$→_{条件}^{试剂}$…产物.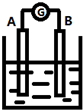 如图为原电池装置示意图:
如图为原电池装置示意图: