题目内容
10.溴化氢是一种有辛辣刺激气味的无色气体,易溶于水、乙醇,在医药上还可以用来合成镇咳类非处方药物(如分子式为C18H25NO•HBr的氢溴酸右美沙芬等).氢溴酸是溴化氢的水溶液.某研究单位模拟工业制备氢溴酸的流程如下: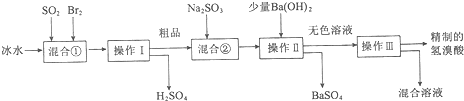
请回答以下问题:
(1)混合①中反应的离子方程式为SO2+Br2+2H2O=4H++2Br-+SO42-.
(2)操作Ⅱ的名称是过滤.
(3)混合①中使用冰水的目的是降低体系温度,防止溴蒸发,使反应完全;
混合②中加入适量Na2SO3的目的是除去粗品中未反应完的溴.
(4)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)带有淡淡的黄色,于是研究人员甲和乙分别设计了简单实验加以探究:
①甲推测工业氢溴酸呈淡黄色是因为含有Fe3+,用于证明该推测所用的试剂为KSCN溶液;
②乙推测工业氢溴酸呈淡黄色是因为含有Br2,用于证明该推测所用的试剂为CCl4.
(5)完成操作Ⅱ之前向混合液中加入了少量Ba(OH)2,能否用BaCl2或Ba(NO3)2代替Ba(OH)2?否(填“能”或“否”),原因是会引入HCl或HNO3杂质,而使制备的氢溴酸不存(若前一空填“能”,此处不作答).
分析 制备溴化氢的流程中,二氧化硫与溴水反应生成氢硫酸和硫酸,采用冰水是为了降低体系温度,防止溴蒸发,根据不同温度溶解性的不同,分离含有挥发出来的溴和氢溴酸的混合物,在用亚硫酸钠溶液除去氢溴酸中的杂质溴单质,但此过程引入杂质离子硫酸根,故用氢氧化钡除去,最终制备较纯净的氢溴酸,据此分析回答,
(1)Br2具有强氧化性,在溶液中将SO2氧化为H2SO4,自身被还原为HBr;
(2)由工艺流程可知,操作Ⅱ分离固体与液体,应是过滤;
(3)Br2氧化SO2放出很多热量,溴易挥发;粗品中可能含有为反应的Br2,应除去Br2;
(4)①用KSCN溶液检验Fe3+,滴加KSCN溶液,溶液变成血红色;
②由工艺流程可知,溶液中可能含有Br2,可以用CCl4萃取方法检验;
(5)用Ba(OH)2会引入HCl或HNO3杂质,而使制备的氢溴酸不存.
解答 解:制备溴化氢的流程中,二氧化硫与溴水反应生成氢硫酸和硫酸,采用冰水是为了降低体系温度,防止溴蒸发,根据不同温度溶解性的不同,分离含有挥发出来的溴和氢溴酸的混合物,在用亚硫酸钠溶液除去氢溴酸中的杂质溴单质,但此过程引入杂质离子硫酸根,故用氢氧化钡除去,最终制备较纯净的氢溴酸,
(1)Br2具有强氧化性,在溶液中将SO2氧化为H2SO4,自身被还原为HBr,反应方程式为SO2+Br2+2H2O=2HBr+H2SO4,离子方程式为SO2+Br2+2H2O=4H++2Br-+SO42-,
故答案为:SO2+Br2+2H2O=4H++2Br-+SO42-;
(2)由工艺流程可知,操作Ⅱ分离固体与液体,应是过滤,
故答案为:过滤;
(3)Br2氧化SO2放出很多热量,溴易挥发,使用冰水,降低体系温度,防止溴蒸发,使反应完全,粗品中可能含有为反应的Br2,加入Na2SO3,除去粗品中未反应完的溴,
故答案为:降低体系温度,防止溴蒸发,使反应完全;除去粗品中未反应完的溴;
(4)①用KSCN溶液检验Fe3+,取少许溶液滴加KSCN溶液,溶液变成血红色,说明氢溴酸呈淡黄色是因为含Fe3+,
故答案为:KSCN溶液;
②由工艺流程可知,溶液中可能含有Br2,可以用CCl4萃取方法检验,取少许溶液加振荡、静置分层,下层呈橙红色,说明氢溴酸呈淡黄色是因为含Br2,
故答案为:Br2;CCl4;
(5)用BaCl2或Ba(NO3)2会引入HCl或HNO3杂质,而使制备的氢溴酸不存,故不能用BaCl2或Ba(NO3)2代替Ba(OH)2,
故答案为:否;会引入HCl或HNO3杂质,而使制备的氢溴酸不存否 会引入HCl或HNO3杂质,而使制备的氢溴酸不存.
点评 本题以制备氢溴酸为载体,考查学生对工艺流程的理解、物质的分离提纯等基本操作、离子检验、物质性质等,难度中等,是对知识的综合运用,需学生具有扎实的基础知识与灵活运用知识解决问题的能力.

①福尔马林 ②酒精 ③KMnO4溶液 ④硫酸钠 ⑤硝酸银溶液 ⑥双氧水 ⑦硝酸.
| A. | 除④⑦外 | B. | 除③⑥外 | C. | ①②⑤ | D. | 除④外 |
| A. | CH3CH=CH2与 | B. |  与 与 | ||
| C. | CH3CH2Cl 与CH3CHClCH2Cl | D. |  与 与 |
| A. | KMnO4溶液 | B. | KBr溶液 | C. | 溴水 | D. | AgNO3溶液 |
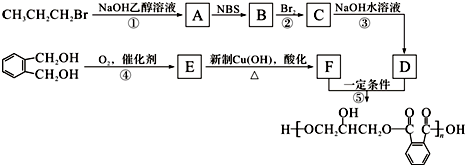
方法一:将碳酸锂、乙酸亚铁[(CH3COO)2Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出.
方法二:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀.沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂.
方法三:某化工厂以铁红、锂辉石LiAl(SiO3)2(含少量Ca2+、Mg2+的盐)、碳粉等原料来生产磷酸亚铁锂.其主要工艺流程如图:

已知:2LiAl(SiO3)2+H2SO4(浓)$\frac{\underline{\;250-300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O↓
| 温度/℃ | 20 | 40 | 60 | 80 |
| 溶解度(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| 溶解度(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
(1)在方法一所发生的反应中,除生成磷酸亚铁锂、乙酸外,还有H2OCO2、NH3(填化学式)等气体生成.
(2)在方法二中,阳极生成磷酸亚铁锂的电极反应式为Fe+H2PO4-+Li+-2e-=LiFePO4+2H+
(3)在方法三中,从滤渣Ⅰ中可分离出Al2O3,如图所示.

①请写出生成沉淀的离子方程式Al3++3NH3•H2O=Al(OH)3↓+3NH4+
②滤渣Ⅱ的主要成分是:Mg(OH)2、CaCO3(填化学式).
③写出在高温下生成磷酸亚铁锂的化学方程式2FePO4+Li2CO3+2C$\frac{\underline{\;高温\;}}{\;}$2LiFePO4+3CO↑.
(4)在锂离子电池中,需要一种有机聚合物作为正负极之间锂离子迁移的介质,该有机聚合物的单体之一的结构简式如下:
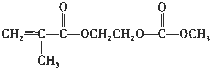 ,写出该单体与足量氢氧化钠溶液反应的化学方程式:
,写出该单体与足量氢氧化钠溶液反应的化学方程式: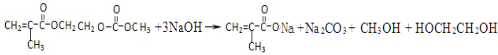 .
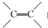
.(5)磷酸铁锂动力电池(简称LFP)是一种高效、长寿命的二次电池,其工作原理为:C6Li+FePO4$?_{充电}^{放电}$C6Li(1-x)+(1-x)FePO4+xLiFePO4,电池充电时,阳极中的Li+通过聚合物隔膜向阴极迁移;在放电时,负极中Li+的通过隔膜向正极迁移.充电时的阴极反应式C6Li(1-x)+xLi++xe-═C6Li,若用该电池电解精炼铜,阴极质量增重12.8g,则电池中经过聚合物隔膜的Li+数目为0.4NA.
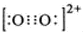 ;1mol O22+中含有的π键数目为2NA.
;1mol O22+中含有的π键数目为2NA.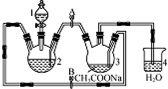 醋酸亚铬水合物{[Cr(CH3COO)2]2•2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂,实验室中以锌粒,三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,且仪器2中预先加入锌粒,已知二价铬不稳定,极易被氧气氧化,不与锌反应.制备过程中发生的相关反应如下:
醋酸亚铬水合物{[Cr(CH3COO)2]2•2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂,实验室中以锌粒,三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,且仪器2中预先加入锌粒,已知二价铬不稳定,极易被氧气氧化,不与锌反应.制备过程中发生的相关反应如下: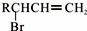 .
.
 ,C的名称是1,2,3-三溴丙烷.
,C的名称是1,2,3-三溴丙烷.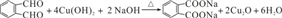 ;
;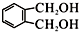 的同分异构体中同时符合下列条件的芳香族化合物共有6种.
的同分异构体中同时符合下列条件的芳香族化合物共有6种.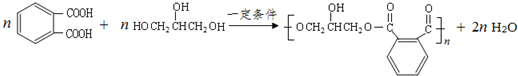 .
.