题目内容
2.新型锂离子电池在新能源的开发中占有重要地位,可用作节能环保电动汽车的动力电池.磷酸亚铁锂(LiFePO4)是新型锂离子电池的首选电极材料,它的制备方法如下:方法一:将碳酸锂、乙酸亚铁[(CH3COO)2Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出.
方法二:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀.沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂.
方法三:某化工厂以铁红、锂辉石LiAl(SiO3)2(含少量Ca2+、Mg2+的盐)、碳粉等原料来生产磷酸亚铁锂.其主要工艺流程如图:

已知:2LiAl(SiO3)2+H2SO4(浓)$\frac{\underline{\;250-300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O↓
| 温度/℃ | 20 | 40 | 60 | 80 |
| 溶解度(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| 溶解度(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
(1)在方法一所发生的反应中,除生成磷酸亚铁锂、乙酸外,还有H2OCO2、NH3(填化学式)等气体生成.
(2)在方法二中,阳极生成磷酸亚铁锂的电极反应式为Fe+H2PO4-+Li+-2e-=LiFePO4+2H+
(3)在方法三中,从滤渣Ⅰ中可分离出Al2O3,如图所示.

①请写出生成沉淀的离子方程式Al3++3NH3•H2O=Al(OH)3↓+3NH4+
②滤渣Ⅱ的主要成分是:Mg(OH)2、CaCO3(填化学式).
③写出在高温下生成磷酸亚铁锂的化学方程式2FePO4+Li2CO3+2C$\frac{\underline{\;高温\;}}{\;}$2LiFePO4+3CO↑.
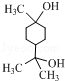
(4)在锂离子电池中,需要一种有机聚合物作为正负极之间锂离子迁移的介质,该有机聚合物的单体之一的结构简式如下:
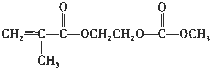 ,写出该单体与足量氢氧化钠溶液反应的化学方程式:
,写出该单体与足量氢氧化钠溶液反应的化学方程式: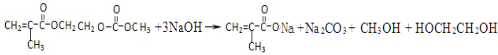 .
.(5)磷酸铁锂动力电池(简称LFP)是一种高效、长寿命的二次电池,其工作原理为:C6Li+FePO4$?_{充电}^{放电}$C6Li(1-x)+(1-x)FePO4+xLiFePO4,电池充电时,阳极中的Li+通过聚合物隔膜向阴极迁移;在放电时,负极中Li+的通过隔膜向正极迁移.充电时的阴极反应式C6Li(1-x)+xLi++xe-═C6Li,若用该电池电解精炼铜,阴极质量增重12.8g,则电池中经过聚合物隔膜的Li+数目为0.4NA.
分析 方法三:2LiAl(SiO3)2+H2SO4(浓)$\frac{\underline{\;250-300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O↓,冷却加水过滤得到滤液I和滤渣I,滤渣中含有Al2O3•4SiO2•H2O↓,滤液中含有Li2SO4、MgSO4、CaSO4,向滤液中加入NaOH、Na2CO3,镁离子和NaOH反应生成氢氧化镁沉淀,钙离子和碳酸钠反应生成碳酸钙沉淀,所以滤渣II为Mg(OH)2、CaCO3,滤液中含有硫酸锂,向滤液中加入饱和碳酸钠得到碳酸锂沉淀,铁和磷酸反应生成磷酸铁,C、磷酸铁和碳酸锂在高温下反应生成LiFePO4;
(1)在方法一所发生的反应中,除生成磷酸亚铁锂、乙酸外,还有H2O,该反应中铵根离子生成氨气、碳酸根离子生成二氧化碳;
(2)在方法二中,阳极上Fe失电子和磷酸二氢根离子、锂离子反应生成磷酸亚铁锂;
(3)在方法三中,从滤渣Ⅰ溶于酸得到铝离子,氢氧化铝不溶于弱碱但能溶于强碱,所以a为氨水,向溶液中加入氨水得到Al(OH)3沉淀,灼烧Al(OH)3沉淀得到Al2O3;
①铝离子和一水合氨反应生成Al(OH)3沉淀;
②滤渣Ⅱ的主要成分是:Mg(OH)2、CaCO3;
③在高温下生成磷酸亚铁锂,根据反应物、生成物和反应条件书写方程式;
(4)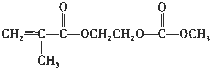 中含有酯基,能和NaOH反应生成酸式盐和醇;
中含有酯基,能和NaOH反应生成酸式盐和醇;
(5)磷酸铁锂动力电池(简称LFP)工作原理为:C6Li+FePO4$?_{充电}^{放电}$C6Li(1-x)+(1-x)FePO4+xLiFePO4,充电时的阴极上C6Li(1-x)得电子发生还原反应,若用该电池电解精炼铜,阴极质量增重12.8g,则阴极析出n(Cu)=$\frac{12.8g}{64g/mol}$=0.2mol,铜离子得到的电子为0.4mol,则电池中通过聚合物隔膜的Li+数目为0.4NA.
解答 解:方法三:2LiAl(SiO3)2+H2SO4(浓)$\frac{\underline{\;250-300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O↓,冷却加水过滤得到滤液I和滤渣I,滤渣中含有Al2O3•4SiO2•H2O↓,滤液中含有Li2SO4、MgSO4、CaSO4,向滤液中加入NaOH、Na2CO3,镁离子和NaOH反应生成氢氧化镁沉淀,钙离子和碳酸钠反应生成碳酸钙沉淀,所以滤渣II为Mg(OH)2、CaCO3,滤液中含有硫酸锂,向滤液中加入饱和碳酸钠得到碳酸锂沉淀,铁和磷酸反应生成磷酸铁,C、磷酸铁和碳酸锂在高温下反应生成LiFePO4;
(1)在方法一所发生的反应中,除生成磷酸亚铁锂、乙酸外,还有H2O,该反应中铵根离子生成氨气、碳酸根离子生成二氧化碳,所以生成的物质中还含有的气体是CO2、NH3,故答案为:CO2、NH3;
(2)在方法二中,阳极上Fe失电子和磷酸二氢根离子、锂离子反应生成磷酸亚铁锂,电极反应式为Fe+H2PO4-+Li+-2e-=LiFePO4+2H+,
故答案为:Fe+H2PO4-+Li+-2e-=LiFePO4+2H+;
(3)在方法三中,从滤渣Ⅰ溶于酸得到铝离子,氢氧化铝不溶于弱碱但能溶于强碱,所以a为氨水,向溶液中加入氨水得到Al(OH)3沉淀,灼烧Al(OH)3沉淀得到Al2O3;
①铝离子和一水合氨反应生成Al(OH)3沉淀,离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
②滤渣Ⅱ的主要成分是:Mg(OH)2、CaCO3,故答案为:Mg(OH)2、CaCO3;
③在高温下生成磷酸亚铁锂,根据反应物、生成物和反应条件书写方程式为2FePO4+Li2CO3+2C $\frac{\underline{\;高温\;}}{\;}$2LiFePO4+3CO↑,
故答案为:2FePO4+Li2CO3+2C $\frac{\underline{\;高温\;}}{\;}$2LiFePO4+3CO↑;
(4)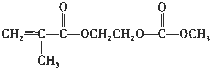 中含有酯基,能和NaOH反应生成酸式盐和醇,反应方程式为
中含有酯基,能和NaOH反应生成酸式盐和醇,反应方程式为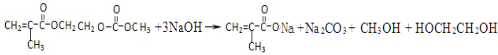 ,故答案为:
,故答案为: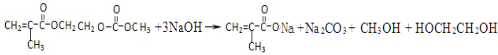 ;
;
(5)磷酸铁锂动力电池(简称LFP)工作原理为:C6Li+FePO4$?_{充电}^{放电}$C6Li(1-x)+(1-x)FePO4+xLiFePO4,充电时的阴极上C6Li(1-x)得电子发生还原反应,阴极反应式为C6Li(1-x)+xLi++xe-═C6Li,若用该电池电解精炼铜,阴极质量增重12.8g,则阴极析出n(Cu)=$\frac{12.8g}{64g/mol}$=0.2mol,铜离子得到的电子物质的量=0.2mol×2=0.4mol,根据电荷守恒则电池中通过聚合物隔膜的Li+数目为0.4NA,
故答案为:C6Li(1-x)+xLi++xe-═C6Li; 0.4NA.
点评 本题考查物质的分离和提纯,综合性较强,涉及原电池原理、有机物性质、物质分离和提纯试剂的选取等知识点,明确化学反应原理、物质性质及性质差异性是解本题关键,侧重考查学生分析计算及综合知识运用能力,难点是电极反应式的书写.

 阅读快车系列答案
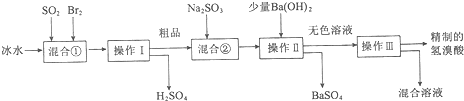
阅读快车系列答案①石灰水 ②酸性KMnO4溶液 ③溴水 ④用硝酸酸化的Ba(NO3)2溶液 ⑤品红溶液.
| A. | ①②③⑤ | B. | ②③④⑤ | C. | 只有① | D. | ①② |
已知:
| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
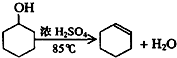
将12.5mL环己醇加入试管A中,再加入lml浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A采用水浴加热的优点是均匀受热,容易控制反应温度.
②试管C置于冰水浴中的目的是试管C置于冰水浴中.
(2)制备精品 ①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在上层(填上或下),分液后用c(填字母,单选)洗涤.
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按图2装置蒸馏,冷却水从g口进入(填g或f).蒸馏时要加入生石灰,目的是生石灰吸收水分,便于蒸馏出更纯净的产品.
③收集产品时,控制的温度应在83℃左右,实验制得的环己烯精品质量低于理论产量,可能的原因是c(填字母,单选).
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是bc.
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点.
 碳纳米管有单层或多层石墨层卷曲而成,其结构类似于石墨(如图),每个碳原子通过sp2杂化与周围碳原子成键.
碳纳米管有单层或多层石墨层卷曲而成,其结构类似于石墨(如图),每个碳原子通过sp2杂化与周围碳原子成键.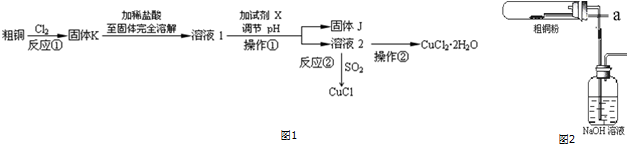
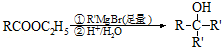
 .
. .
. .
. .
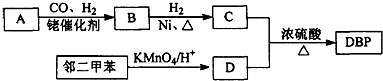
.

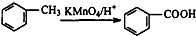
 .
. .
.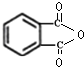 .
.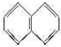 .
.