题目内容
7.a、b、c、d四个金属电极,有关的实验装置现象如表所示:由此判断这四个电极对应的金属活动性由强到弱的顺序为( )| 装置 | 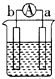 CuSO4溶液 | 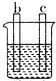 稀硫酸 |  稀硫酸 |
| 现象 | a极质量减小 b极质量增大 | b极有气泡 c极无明显现象 | 电流从a极流向d极 |
| A. | d>a>b>c | B. | b>c>d>a | C. | a>b>c>d | D. | a>b>d>c |
分析 在原电池中,一般来说,活泼金属作负极、较不活泼金属作正极,负极上金属失电子发生氧化反应、正极上得电子发生还原反应,电流从正极沿导线流向负极,以此解答该题.
解答 解:在原电池中,一般来说,活泼金属作负极、较不活泼金属作正极,负极上金属失电子发生氧化反应、正极上得电子发生还原反应,电流从正极沿导线流向负极,
第一个装置中,a极质量减小、b极质量增大,说明a极上金属失电子发生氧化反应、b电极上得电子发生还原反应,所以金属性a>b;
第二个装置中,b和稀硫酸反应生成氢气,说明b位于H元素之前,c极无明显现象,说明c位于H元素之后;
第三个装置中,电流从a流向d,则金属活动性d>a,
通过以上分析知,金属活动性强弱顺序是d>a>b>c,
故选A.
点评 本题以原电池原理为载体考查金属活动性强弱判断,侧重于学生的分析能力的考查,正确判断正负极是解本题关键,注意不能根据得失电子多少判断金属活动性强弱,要根据得失电子难易程度判断,题目难度不大.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
17.工业上合成氨的反应:N2(g)+3H2(g)?2NH3(g)△H=-92.60kJ•mol-1
(1)下列说法能说明上述反应向正反应方向进行的是bd(填序号).
a.单位时间内生成2a mol NH3的同时生成3a mol H2
b.单位时间内生成6a mol N-H键的同时生成2a mol H-H键
c.用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2
d.混合气体的平均摩尔质量增大
e.容器内的气体密度不变
(2)已知合成氨反应在某温度下2L的密闭容器中进行,测得如表数据:根据表中数据计算:
①反应进行到4h时放出的热量为46.30.
②根据计算可得m=0.6,0~2h内NH3的平均反应速率为0.15mol/(L•h),.
③此温度下反应:2NH3?N2+3H2的化学平衡常数K=6.75.
(1)下列说法能说明上述反应向正反应方向进行的是bd(填序号).
a.单位时间内生成2a mol NH3的同时生成3a mol H2
b.单位时间内生成6a mol N-H键的同时生成2a mol H-H键
c.用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2
d.混合气体的平均摩尔质量增大
e.容器内的气体密度不变
(2)已知合成氨反应在某温度下2L的密闭容器中进行,测得如表数据:根据表中数据计算:
| 时间(h) 物质的量(mol) | 0 | 2 | 4 | 6 |
| N2 | 1.50 | 1.20 | 1.00 | 1.00 |
| H2 | 4.50 | 3.60 | 3.00 | 3.00 |
| NH3 | 0 | m | 1.00 | 1.00 |
②根据计算可得m=0.6,0~2h内NH3的平均反应速率为0.15mol/(L•h),.
③此温度下反应:2NH3?N2+3H2的化学平衡常数K=6.75.
18.对于原电池的电极名称叙述有错误的是( )
| A. | 发生氧化反应的为负极 | B. | 正极为电子流入的一极 | ||
| C. | 比较不活泼的金属为负极 | D. | 电流的方向由正极到负极 |
15.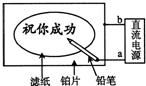 某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是( )
某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是( )
 某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是( )
某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是( )| A. | 铅笔端作阳极,发生氧化反应 | B. | 铂片端作阴极,发生还原反应 | ||
| C. | 铅笔端有少量的氯气产生 | D. | a点是负极,b点是正极 |
2.关于下列各装置图的叙述中,不正确的是( )
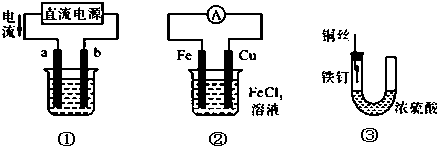

| A. | 用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 | |
| B. | 用装置①进行电镀,镀件接在b极上 | |
| C. | 装置②的总反应是:Cu+Fe3+═Cu2++Fe | |
| D. | 装置③中的铁钉几乎没被腐蚀 |
19.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H-1O$?_{充电}^{放电}$ 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
| A. | 放电时每转移3mol电子,正极有1mol K2FeO4被氧化 | |
| B. | 充电时阳极反应为:Fe(OH)3-3e-+5 OH-═FeO${\;}_{4}^{2-}$+4H2O | |
| C. | 放电时正极附近溶液的碱性增强 | |
| D. | 放电时负极反应为:Zn-2e-+2OH-═Zn(OH)2 |
17.下列指定反应的离子方程式正确的是( )
| A. | 用纯碱溶液溶解苯酚:CO32-+C6H5OH→C6H5O-+HCO3- | |
| B. | 用强碱溶液吸收工业制取硝酸尾气:NO+NO2+2OH-═2NO3-+H2O | |
| C. | 用二氧化锰和浓盐酸反应制氯气:MNO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O | |
| D. | 向AlCl3溶液中滴加过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |

 .若H分子中所有碳原子均在一条直线上,则G转化为H的化学方程式为CH3CHBrCHBrCH3+2NaOH$→_{△}^{醇}$H3CC≡CCH3↑+2NaBr+2H2O.
.若H分子中所有碳原子均在一条直线上,则G转化为H的化学方程式为CH3CHBrCHBrCH3+2NaOH$→_{△}^{醇}$H3CC≡CCH3↑+2NaBr+2H2O. .
.
