题目内容
16.二氧化硫的转化是资源利用和环境保护的重要研究课题.将二氧化硫进行转化利用有多种方法.
(1)已知2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1
CaCO3(s)═CaO(s)+CO2(g)△H=+178.5kJ•mol-1
CaSO4(s)═CaO(s)+SO3(g)△H=+401.9kJ•mol-1
则“钙基固硫”的热化学方程式为:2CaCO(s)+2SO(g)+O(g)═2CaSO(s)+2CO(g)△H=-643400J•mol-1
(2)可利用海水对含SO 的烟气进行脱硫,已知海水呈弱碱性,主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO2-4、Br-、HCO-3等离子.其工艺流程如图所示:

①向曝气池中通入空气的目的将H2SO3、HSO3-等氧化为SO42-.
②通入空气后曝气池中的海水与天然海水相比,浓度有明显不同的离子是bd.
a.Cl- b.SO42- c.Br- d.HCO3-
(3)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如题图1所示.(电极材料为石墨)
①b极的电极反应式为SO32--2e-+H2O=SO42-+2H+.
②电解过程中a极区碱性明显增强,用平衡移动原理解释原因H2O?H++OH-,在阴极H+放电生成H2,c(H+)减小,水的电离平衡正向移动,碱性增强.
(4)氧化锌吸收法.配制ZnO悬浊液,在吸收塔中封闭循环脱硫,发生的主要反应为ZnO(s)+SO2(g)=ZnSO3(s),测得pH、吸收效率η随时间t的变化如题图2所示.
①pH-t曲线中cd段发生的主要反应的化学方程式为ZnSO3+SO2+H2O=Zn(HSO3)2.
②为提高SO2的吸收效率η,可采取的措施为增大悬浊液中ZnO的量或适当提高单位时间内烟气的循环次数.(任写一条)

分析 (1)已知①2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1
②CaCO3(s)═CaO(s)+CO2(g)△H=+178.5kJ•mol-1
③CaSO4(s)═CaO(s)+SO3(g)△H=+401.9kJ•mol-1
依据盖斯定律计算①-2×(②-③)得到“钙基固硫”的热化学方程式;
(2)①含SO2的烟气可利用海水脱硫,向曝气池中通入空气的目的是把H2SO3、HSO3-等氧化为SO42-;
②由上一问可知硫酸根浓度肯定增大,天然海水呈弱碱性,通入空气后曝气池中的海水会生成酸性物质会消耗HCO3-,HCO3-会减少;
(3)①SO32-放电的电极反应式为SO32--2e-+H2O=SO42-+2H+,
②在阴极H+放电生成H2,c(H+)减小,水的电离平衡H2O?H++OH-正向移动,所以碱性增强;
(4)①cd段溶液的pH介于4~6之间,结合图3可知,该pH条件下溶液中主要存在亚硫酸氢根离子,则pH-t曲线cd段发生反应为亚硫酸锌与二氧化硫反应生成亚硫酸氢锌;
②根据图2中SO2的吸收效率η与时间、溶液的pH的关系对各选项进行判断.
解答 解:(1)已知①2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1
②CaCO3(s)═CaO(s)+CO2(g)△H=+178.5kJ•mol-1
③CaSO4(s)═CaO(s)+SO3(g)△H=+401.9kJ•mol-1
依据盖斯定律计算①-2×(②-③)得到“钙基固硫”的热化学方程式为:2CaCO3(s)+2SO2(g)+O2(g)═2CaSO4(s)+2CO2(g)△H=-643.4KJ/mol=-643400J/mol,
故答案为:2CaCO3(s)+2SO2(g)+O2(g)═2CaSO4(s)+2CO2(g)△H=-643.4KJ/mol=-643400J/mol;
(2)①含SO2的烟气可利用海水脱硫,向曝气池中通入空气的目的是把H2SO3、HSO3-等氧化为SO42-,
故答案为:将H2SO3、HSO3-等氧化为SO42-;
②由上一问可知硫酸根浓度肯定增大,天然海水呈弱碱性,通入空气后曝气池中的海水会生成酸性物质会消耗HCO3-,HCO3-会减少,
故答案为:bd;
(3)①SO32-失去电子被氧化成SO42-,电极反应式为:SO32--2e-+H2O=SO42-+2H+,故答案为:SO32--2e-+H2O=SO42-+2H+;
②在阴极H+放电生成H2,c(H+)减小,水的电离平衡H2O?H++OH-正向移动,所以碱性增强;
故答案为:H2O?H++OH-,在阴极H+放电生成H2,c(H+)减小,水的电离平衡正向移动,碱性增强;
(4)①cd段溶液的pH介于4~6之间,结合图3可知,该pH条件下溶液中主要存在亚硫酸氢根离子,则pH-t曲线cd段发生的主要反应为:ZnSO3+SO2+H2O=Zn (HSO3)2,
故答案为:ZnSO3+SO2+H2O=Zn (HSO3)2;
②增大悬浊液中ZnO的量,可以充分吸收二氧化硫,从而提高吸收效率,适当提高单位时间内烟气的循环次数,可以使二氧化硫充分吸收,从而提高了二氧化硫的吸收效率,
故答案为:增大悬浊液中ZnO的量或适当提高单位时间内烟气的循环次数;
点评 本题考查了热化学方程式书写、生产工艺流程、电解池原理的分析,是化学与技术的典型题目,仔细分析生产工艺流程,电解池阴极阳极的判断和电极反应式的书写是解题关键,注意图象的理解应用,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案⑦氨水 ⑧稀硝酸 ⑨KI
(1)按物质的分类方法填写表格的空白处(填物质编号)
| 分类标准 | 电解质 | 盐 | 非电解质 | 混合物 |
| 属于该类 的物质 |
| 装置 | 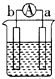 CuSO4溶液 | 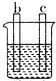 稀硫酸 |  稀硫酸 |
| 现象 | a极质量减小 b极质量增大 | b极有气泡 c极无明显现象 | 电流从a极流向d极 |
| A. | d>a>b>c | B. | b>c>d>a | C. | a>b>c>d | D. | a>b>d>c |
H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ•mol-1,又知在溶液中反应有:
CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l);△H=-Q1kJ•mol-1,
$\frac{1}{2}$H2SO4(浓)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l);△H=-Q2 kJ•mol-1
HNO3(aq)+KOH(aq)═KNO3(aq)+H2O(l);△H=-Q3 kJ•mol-1,
则Q1、Q2、Q3的关系正确的是( )
| A. | Q1=Q2=Q3 | B. | Q2>Q1>Q3 | C. | Q2>Q3>Q1 | D. | Q2=Q3>Q1 |
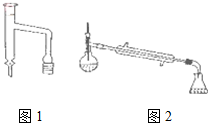 乙酸环己酯具有香蕉及苹果气味,主要用于配制各种饮料、冰淇淋等,实验室制备乙酸环己酯的反应原理、装置示意图和有关数据如下:
乙酸环己酯具有香蕉及苹果气味,主要用于配制各种饮料、冰淇淋等,实验室制备乙酸环己酯的反应原理、装置示意图和有关数据如下: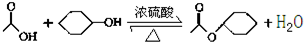
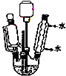 | 相对分子质量 | 密度/g•cm-3 | 沸点 | 水中溶解性 | |
| 乙酸 | 60 | 1.051 | 118.0 | 溶 | |
| 环己醇 | 100 | 0.962 | 160.8 | 微溶 | |
| 乙酸环己酯 | 142 | 0.969 | 173.5 | 难溶 |
将12.0g(0.2mol)乙酸、l0.0g(0.1mol)环己醇和15mL环己烷加入装有温度计、恒压滴液漏斗和球形冷凝管的四颈烧瓶中,在搅拌下,慢慢滴加15mL 98%浓硫酸,滴加完后将恒压滴液漏斗换成分水器装置,加热回流90min后,向反应液中依次加入水、10%的NaHCO3溶液、水洗涤,然后加无水MgSO4,放置过夜,加热蒸馏,收集168-174℃的馏分,得到无色透明、有香味的液体产品6.9g
(1)上述反应装置图中存在的一处错误是冷凝水应从下口进上口出.
(2)实验中控制乙酸的物质的量是环己醇的2倍,其目的是提高环已醇的转化率.
(3)分水器(图1)的作用是将生成的水及时从体系中分离出来,提高反应物的转化率.
(4)用l0%的NaHCO3溶液洗涤的目的是洗去硫酸和醋酸;第二次水洗的目的是洗去碳酸氢钠;加入无水MgSO4的目的是干燥.
(5)本次实验的产率为48.6%.(保留3位有效数字)
(6)若在进行蒸馏操作时,采用图2装置,会使实验的产率偏高
(填“偏高”或“偏低”),其原因是产品中会收集到未反应的环己醇.
| A. | 合金中至少含有两种金属 | |
| B. | 漂白粉能在空气中长期存放 | |
| C. | 工艺师利用氢氟酸刻蚀石英制作艺术品 | |
| D. | NaOH溶液保存在配有磨口玻璃塞的细口试剂瓶中 |
| A. | 钠能与硫酸铜稀溶液反应,置换出红色的铜 | |
| B. | 为了消除碘缺乏病,在食用盐中必须加入一定量的单质碘 | |
| C. | 过氧化钠是淡黄色固体,可用作呼吸面具的供氧剂 | |
| D. | 氢气在氧气或氯气中燃烧,都能观察到淡蓝色火焰 |
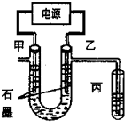 CuCl2溶液中的铜主要以Cu (H2O)42+、CuCl42-形式存在,它们间有如下转化关系:Cu (H2O)42+ (蓝色)+4Cl-?CuCl42- (黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电.下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝.回答下列问题:
CuCl2溶液中的铜主要以Cu (H2O)42+、CuCl42-形式存在,它们间有如下转化关系:Cu (H2O)42+ (蓝色)+4Cl-?CuCl42- (黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电.下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝.回答下列问题: