题目内容
15.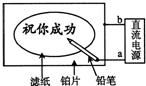 某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是( )
某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是( )| A. | 铅笔端作阳极,发生氧化反应 | B. | 铂片端作阴极,发生还原反应 | ||
| C. | 铅笔端有少量的氯气产生 | D. | a点是负极,b点是正极 |
分析 此为电解氯化钠溶液的实验装置,电解时的阴极反应为:2H++2e-═H2↑,或2H2O+2e-═H2↑+2OH-,阳极发生的反应为:2Cl--2e-═Cl2↑,
总反应为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑,阴极溶液呈碱性,滴加酚酞溶液呈红色,以此回答.
解答 解:A、用铅笔在滤纸上写字,会出现红色字迹,说明铅笔做阴极,阴极上发生2H2O+2e-═H2↑+2OH-,溶液呈碱性,滴加酚酞溶液呈红色,故A错误;
B、阴极发生还原反应,阳极发生氧化反应,在该电解池中,铅笔做阴极,铂片做阳极,故B错误;
C、铅笔做阴极,反应为:2H++2e-═H2↑,或2H2O+2e-═H2↑+2OH-,有氢气产生,故C错误;
D、用铅笔在滤纸上写字,会出现红色字迹,说明铅笔做阴极,连接电源的负极,即a为负极,则b为正极,故D正确.
故选:D.
点评 本题考查电解原理及应用,题目难度不大,做题时注意从反应的现象判断电解池的阴阳极入手来解答,注意把握电极反应和溶液离子浓度的变化.

练习册系列答案
相关题目
5.研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.
(1)CO可用于炼铁,
已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1
C(s)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1
则CO还原Fe2O3(s)的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol.
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液).写出该电池的正极反应式:O2+4e-+2H2O=4OH-.
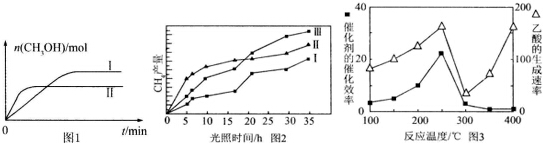
(3)CO2和H2充人一定体积的密闭容器中,在两种温度下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 测得CH3OH的物质的量随时间的变化见图1.
①线Ⅰ、Ⅱ对应的平衡常数大小关系为KI>KⅡ (填“>”或“=”或“<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为0.4<n(c)≤1mol.
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2.紫外光照射时,在不同催化
剂(Ⅰ、Ⅱ,Ⅲ)作用下,CH4产量随光照时间的变化见图2.在O~15小时内,CH4的平均生成速率Ⅰ、Ⅱ和Ⅲ从大到小的顺序为II>III>I(填序号).
(5)以TiO2/Cu2Al2O4 为催化剂,可以将CO2和CH4直接转化成乙酸.在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图3.
①乙酸的生成速率主要取决于温度影响的范围是300℃~400℃.
②Cu2Al2O4可溶于稀硝酸,写出有关的离子方程式:3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.

(1)CO可用于炼铁,
已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1
C(s)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1
则CO还原Fe2O3(s)的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol.
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液).写出该电池的正极反应式:O2+4e-+2H2O=4OH-.
(3)CO2和H2充人一定体积的密闭容器中,在两种温度下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 测得CH3OH的物质的量随时间的变化见图1.
①线Ⅰ、Ⅱ对应的平衡常数大小关系为KI>KⅡ (填“>”或“=”或“<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2、3mol H2 | a mol CO2、b mol H2、 c mol CH3OH(g)、c molH2O(g) |
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2.紫外光照射时,在不同催化
剂(Ⅰ、Ⅱ,Ⅲ)作用下,CH4产量随光照时间的变化见图2.在O~15小时内,CH4的平均生成速率Ⅰ、Ⅱ和Ⅲ从大到小的顺序为II>III>I(填序号).
(5)以TiO2/Cu2Al2O4 为催化剂,可以将CO2和CH4直接转化成乙酸.在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图3.
①乙酸的生成速率主要取决于温度影响的范围是300℃~400℃.
②Cu2Al2O4可溶于稀硝酸,写出有关的离子方程式:3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.
6.现有下列物质:①Na2CO3 ②铜 ③氯化氢 ④CO2⑤NaHSO4 ⑥Ba(OH)2
⑦氨水 ⑧稀硝酸 ⑨KI
(1)按物质的分类方法填写表格的空白处(填物质编号)
(2)物质⑨的稀溶液在空气中被氧化,加入淀粉溶液显蓝色,则反应的离子方程式为O2+4I-+2H2O═2I2+4OH-.
⑦氨水 ⑧稀硝酸 ⑨KI
(1)按物质的分类方法填写表格的空白处(填物质编号)
| 分类标准 | 电解质 | 盐 | 非电解质 | 混合物 |
| 属于该类 的物质 |
10.下列实验装置图合理的是( )
| A. |  装置所示装置可实现反应:Cu+2H2O$\frac{\underline{\;通电\;}}{\;}$Cu(OH)2+H2↑ | |
| B. | 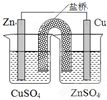 装置能构成锌铜原电池 | |
| C. | 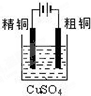 装置可用于粗铜的电解精炼 | |
| D. |  装置可用于在实验室测定中和反应的反应热 |
7.a、b、c、d四个金属电极,有关的实验装置现象如表所示:由此判断这四个电极对应的金属活动性由强到弱的顺序为( )
| 装置 | 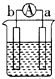 CuSO4溶液 | 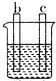 稀硫酸 |  稀硫酸 |
| 现象 | a极质量减小 b极质量增大 | b极有气泡 c极无明显现象 | 电流从a极流向d极 |
| A. | d>a>b>c | B. | b>c>d>a | C. | a>b>c>d | D. | a>b>d>c |
4.强酸和强碱在稀溶液中的中和热可表示为:
H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ•mol-1,又知在溶液中反应有:
CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l);△H=-Q1kJ•mol-1,
$\frac{1}{2}$H2SO4(浓)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l);△H=-Q2 kJ•mol-1
HNO3(aq)+KOH(aq)═KNO3(aq)+H2O(l);△H=-Q3 kJ•mol-1,
则Q1、Q2、Q3的关系正确的是( )
H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ•mol-1,又知在溶液中反应有:
CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l);△H=-Q1kJ•mol-1,
$\frac{1}{2}$H2SO4(浓)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l);△H=-Q2 kJ•mol-1
HNO3(aq)+KOH(aq)═KNO3(aq)+H2O(l);△H=-Q3 kJ•mol-1,
则Q1、Q2、Q3的关系正确的是( )
| A. | Q1=Q2=Q3 | B. | Q2>Q1>Q3 | C. | Q2>Q3>Q1 | D. | Q2=Q3>Q1 |
 如图表示在没有通风橱的条件下制备氯气时设计的装置,图中a、b是可控制的弹簧铁夹.(氯气在饱和氯化钠溶液中的溶解度较小.)
如图表示在没有通风橱的条件下制备氯气时设计的装置,图中a、b是可控制的弹簧铁夹.(氯气在饱和氯化钠溶液中的溶解度较小.)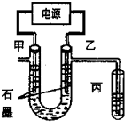 CuCl2溶液中的铜主要以Cu (H2O)42+、CuCl42-形式存在,它们间有如下转化关系:Cu (H2O)42+ (蓝色)+4Cl-?CuCl42- (黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电.下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝.回答下列问题:
CuCl2溶液中的铜主要以Cu (H2O)42+、CuCl42-形式存在,它们间有如下转化关系:Cu (H2O)42+ (蓝色)+4Cl-?CuCl42- (黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电.下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝.回答下列问题: