题目内容
6.醋酸溶液中存在电离平衡CH3COOH?H++CH3COO-,下列叙述正确的是( )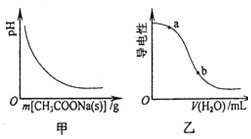
| A. | 图甲表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化 | |
| B. | 图乙表示向CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b | |
| C. | 醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-) | |
| D. | 0.10 mol•L-1的CH3COOH溶液中加水稀释,溶液中c(OH-)减小 |
分析 A.醋酸溶液中存在电离平衡,加入醋酸钠,醋酸根离子浓度增大,平衡逆向进行,溶液中氢离子浓度减小;
B.醋酸溶液加水稀释,促进电离,但平衡状态下的离子浓度减小,导电性减弱;
C.醋酸溶液中存在电荷守恒;
D.醋酸溶液中存在离子积常数,氢离子浓度和氢氧根离子浓度乘积不变.
解答 解:A.醋酸溶液中存在电离平衡,加入醋酸钠,醋酸根离子浓度增大,平衡逆向进行,溶液中氢离子浓度减小,溶液PH增大,图象不变,故A错误;
B.图乙表示向CH3COOH溶液中加水时溶液的导电性变化,随加入水增多氢离子浓度减小,溶液PH增大,CH3COOH溶液的pH:a<b,故B错误;
C.醋酸溶液中存在电荷守恒,c(H+)=c(OH-)+c(CH3COO-),故C正确;
D.0.10 mol•L-1的CH3COOH溶液中加水稀释,温度不变,离子积常数不变,稀释氢离子浓度减小,溶液中c(OH-)增大,故D错误;
故选C.
点评 本题考查了弱电解质电离平衡影响因素、溶液在离子积常数、溶液稀释过程分析等,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
10.下列说法正确的是( )
| A. | 常温下用二氧化锰和浓盐酸反应制取Cl2 | |
| B. | 用饱和氯化钠溶液可以洗涤除去氯化钠固体表面少量氯化钾杂质 | |
| C. | 向某溶液中加入盐酸酸化的BaCl2溶液,产生白色沉淀,可知该溶液中一定含有SO42- | |
| D. | 向浓度均为0.01mol/L的K2SO4和KI混合溶液中滴加Pb(NO3)2溶液,先生成PbI2黄色沉淀 |
7.下列反应的离子方程式正确的是( )
| A. | 铜跟稀HNO3反应:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| B. | 向硫酸铝溶液中加入过量氨水:Al3++3OH-═AlO2-+2H2O | |
| C. | 向Ag(NH3)2NO3溶液中加入盐酸:Ag(NH3)2+2H+═Ag++2NH4+ | |
| D. | NaHSO4溶液和Ba(OH)2溶液混合后溶液呈中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
1.某兴趣小组利用以下实验装置模拟工业炼铁的主要过程:
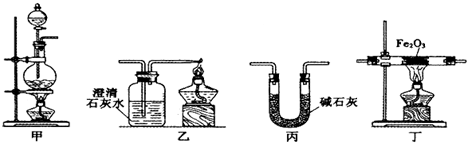
(1)装置甲中发生的反应为:HCOOH(甲酸)$→_{△}^{浓硫酸}$CO↑+H2O.已知甲酸是一种无色有刺激性气味的液体.制取一氧化碳时应该a(填字母).
a.将甲酸滴入浓硫酸 b.将浓硫酸滴入甲酸 c.将甲酸与浓硫酸混合后加入
(2)请按合适的顺序连接好以下装置:甲→丙→丁→乙
(3)丙装置中碱石灰的作用是除去一氧化碳中的甲酸和水蒸气.
(4)实验将近完成时,熄灭装置甲、乙、丁中酒精灯的先后顺序为丁甲乙.
(5)为了探究影响反应产物的外界因素,在Fe2O3与CO反应部位,该小组同学分别用酒精灯和酒精喷灯进行了两次实验,结果如下:
①甲同学猜想黑色产物中可能含有碳单质.乙同学排除了该可能,他提出的两种理由是:碳单质不会被磁铁吸引、从氧化还原角度分析不可能生成碳单质等.
②丙同学查找资料发现,Fe3O4也能被磁铁吸引,对黑色产物成分提出以下三种假设:i.全部为铁;ii.全部为四氧化三铁;iii.四氧化三铁和铁的混合物.

(1)装置甲中发生的反应为:HCOOH(甲酸)$→_{△}^{浓硫酸}$CO↑+H2O.已知甲酸是一种无色有刺激性气味的液体.制取一氧化碳时应该a(填字母).
a.将甲酸滴入浓硫酸 b.将浓硫酸滴入甲酸 c.将甲酸与浓硫酸混合后加入
(2)请按合适的顺序连接好以下装置:甲→丙→丁→乙
(3)丙装置中碱石灰的作用是除去一氧化碳中的甲酸和水蒸气.
(4)实验将近完成时,熄灭装置甲、乙、丁中酒精灯的先后顺序为丁甲乙.
(5)为了探究影响反应产物的外界因素,在Fe2O3与CO反应部位,该小组同学分别用酒精灯和酒精喷灯进行了两次实验,结果如下:
| 加热方式 | 通CO加热 时间/min | 澄清石灰水变 浑浊时间/min | 产物颜色 | 产物能否全部 被磁铁吸引 |
| 酒精灯 | 30 | 5 | 黑色 | 能 |
| 酒精喷灯 | 30 | 1 | 黑色 | 能 |
②丙同学查找资料发现,Fe3O4也能被磁铁吸引,对黑色产物成分提出以下三种假设:i.全部为铁;ii.全部为四氧化三铁;iii.四氧化三铁和铁的混合物.
11.根据原子结构及元素周期律的知识,下列推断正确的是( )
| A. | ${\;}_{17}^{35}$Cl与 ${\;}_{17}^{37}$Cl得电子能力不相同 | |
| B. | 核外电子排布相同的微粒化学性质也相同 | |
| C. | Cl-、S2-、Ca2+、K+半径逐渐减小 | |
| D. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
18.某元素原子37X的核外电子数为17,则该元素原子的中子数是( )
| A. | 17 | B. | 18 | C. | 19 | D. | 20 |
15.下列与化学反应能量变化相关的叙述正确的是( )
| A. | 生成物总能量一定低于反应物总能量 | |
| B. | 放热反应的反应速率总是大于吸热反应的反应速率 | |
| C. | 键能越大,物质越稳定,断键所需的能量就越大 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的所放出的热量不同 |
16.下列说法中,正确的是( )
| A. | 化合物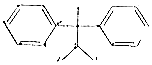 是苯的同系物 是苯的同系物 | |
| B. | 有机物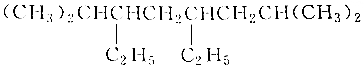 的系统名称是2-甲基-4-乙基-6-异丙基辛烷 的系统名称是2-甲基-4-乙基-6-异丙基辛烷 | |
| C. | C4H8的同分异构体只有3种 | |
| D. | 液化石油气的主要成分是烃,它是一种清洁燃料 |
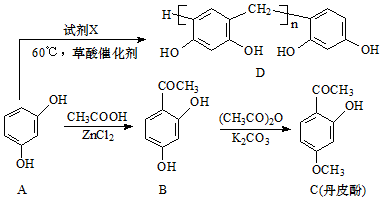
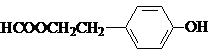 (写结构简式).
(写结构简式).