题目内容
15.下列与化学反应能量变化相关的叙述正确的是( )| A. | 生成物总能量一定低于反应物总能量 | |
| B. | 放热反应的反应速率总是大于吸热反应的反应速率 | |
| C. | 键能越大,物质越稳定,断键所需的能量就越大 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的所放出的热量不同 |
分析 A.反应中一定伴随能量变化,为吸热或放热反应;
B.反应速率与吸热、放热无关;
C.键能越大,断裂化学键吸收的能量越大;
D.热效应与反应条件无关.
解答 解:A.生成物总能量可能高于或低于反应物总能量,故A错误;
B.放热反应的反应速率不一定大于吸热反应的反应速率,二者无必然的关系,故B错误;
C.键能越大,断裂化学键吸收的能量越大,则物质越稳定,故C正确;
D.同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的所放出的热量相同,故D错误;
故选C.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、稳定性与键能关系为解答的关键,侧重分析与应用能力的考查,注意选项D为易错点,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.下列仪器名称为“烧杯”的是( )
| A. |  | B. |  | C. |  | D. |  |
6.醋酸溶液中存在电离平衡CH3COOH?H++CH3COO-,下列叙述正确的是( )
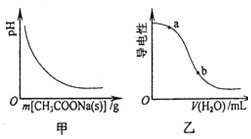

| A. | 图甲表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化 | |
| B. | 图乙表示向CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b | |
| C. | 醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-) | |
| D. | 0.10 mol•L-1的CH3COOH溶液中加水稀释,溶液中c(OH-)减小 |
3.下列离子方程式书写完全正确的是( )
| A. | 用氯化铁溶液腐蚀铜板:Fe3++Cu=Fe2++Cu2+ | |
| B. | NaHSO4溶液与Ba(OH)2溶液混合至溶液显中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| C. | 在碳酸氢镁溶液中加入过量氢氧化钠溶液:Mg2++2HCO3-+4OH-=Mg(OH)2↓+2H2O+2CO32- | |
| D. | 向稀醋酸中加入石灰石:CaCO3+2H+=Ca2++CO2↑+H2O |
20.关于下列四个图象的说法中正确的是( )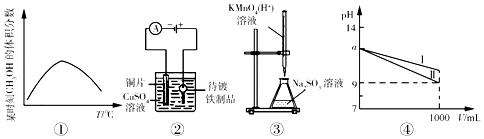

| A. | 图①表示可逆反应“CO(g)+2H2(g)?CH3OH(g)”的△H<0 | |
| B. | 利用图②所示装置,可以实现在铁制品上镀铜 | |
| C. | 图③表示在实验室中用酸性KMnO4溶液滴定Na2SO3溶液 | |
| D. | 图④表示pH=a的NH3•H2O、NaOH稀释过程,其中线I表示NaOH |
7.在某温度下,将2molA和3molB充入一密闭容器中,发生反应:aA(g)+B(g)?C(g)+D(g),5min后达到平衡,测得K=1.若在温度不变的情况下将容器的体积扩大为原来的1倍,测得A的转化率不发生变化,下列说法正确的是( )
| A. | 改变条件前后,B的转化率均为40% | |
| B. | 改变条件前后,C的反应速率保持不变 | |
| C. | 若保持温度和体积不变,在容器中再充入1molA和1molB,B的转化率不变 | |
| D. | 若保持温度和体积不变,在容器中再充入0.5molB、1molC和1molD,B的转化率增大 |
4.检验用硫酸亚铁制得的硫酸铁中是否含有硫酸亚铁,可选用的试剂是( )
| A. | NaOH | B. | KMnO4 | C. | KSCN | D. | 氯水 |
7.地下水受到硝酸盐污染已成为世界范围内一个相当普遍的环境问题.用零价铁去除水体中的硝酸盐(NO3-)是地下水修复研究的热点之一.
(1)Fe还原水体中NO3-的反应原理如图1所示.
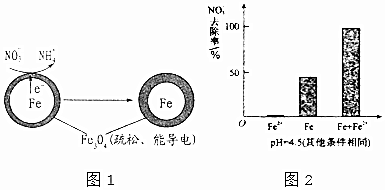
作负极的物质是铁;正极的电极反应式是NO3-+8e-+10H+=NH4++3H2O.
(2)将足量铁粉投入水体中,测定NO3-去除率和pH,结果如表:
在pH=4.5的水体中,NO3-的去除率低的原因是FeO(OH)不导电,阻碍电子转移.
(3)为提高pH=4.5的水体中NO3-的去除率,某课题组在初始pH=4.5的水体中分别投入①Fe2+、②Fe、③Fe和Fe2+做对比实验结果如图2:①此实验可得出的结论是本实验条件下,Fe2+不能直接还原NO3-,在Fe和Fe2+共同作用下能提高NO3-的去除率,Fe2+的作用可能是Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4.表中NO3-去除率和铁的最终物质形态不同的原因初始pH低时,产生的Fe2+充足;初始pH高时,产生的Fe2+不足.
(4)地下水呈中性,在此条件下,要提高NO3-的去除速率,可采取的措施有减小铁粉的颗粒大小,增大反应接触面积或加入活性炭,形成微电池.(写出一条)
(1)Fe还原水体中NO3-的反应原理如图1所示.

作负极的物质是铁;正极的电极反应式是NO3-+8e-+10H+=NH4++3H2O.
(2)将足量铁粉投入水体中,测定NO3-去除率和pH,结果如表:
| 初始pH | pH=2.5 | pH=4.5 |
| 1小时pH | 接近中性 | 接近中性 |
| 24小时pHNO3-的去除率 | 接近100% | <50% |
| 铁的最终物质形态 | 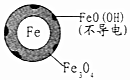 | 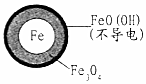 |
(3)为提高pH=4.5的水体中NO3-的去除率,某课题组在初始pH=4.5的水体中分别投入①Fe2+、②Fe、③Fe和Fe2+做对比实验结果如图2:①此实验可得出的结论是本实验条件下,Fe2+不能直接还原NO3-,在Fe和Fe2+共同作用下能提高NO3-的去除率,Fe2+的作用可能是Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4.表中NO3-去除率和铁的最终物质形态不同的原因初始pH低时,产生的Fe2+充足;初始pH高时,产生的Fe2+不足.
(4)地下水呈中性,在此条件下,要提高NO3-的去除速率,可采取的措施有减小铁粉的颗粒大小,增大反应接触面积或加入活性炭,形成微电池.(写出一条)