题目内容
18.某元素原子37X的核外电子数为17,则该元素原子的中子数是( )| A. | 17 | B. | 18 | C. | 19 | D. | 20 |
分析 根据原子中核内质子数=核外电子数=电荷数,中子数=质量数-质子数,据此分析解答.
解答 解:某元素原子37X的核外电子数为17,质子数为17,则该元素原子的中子数=质量数-质子数=37-17=20,
故选D.
点评 本题考查核素的表示方法和质量数与质子数、中子数之间的关系,难度不大,明确原子的质子数和核外电子数的关系是解题的关键.

练习册系列答案
相关题目
1.下列说法中,正确的是( )
| A. | 液氯和氯水都含有氯离子 | |
| B. | 氯气和液氯都能使干燥的有色布条褪色 | |
| C. | 盐酸和氯水都含有氯离子 | |
| D. | 盐酸和氯水都能使湿润的有色布条褪色 |
2.下列溶液中微粒的物质的量浓度关系一定正确的是( )
| A. | 某温度下,pH=7的NH4Cl与NH3•H2O的混合溶液:c(NH4+)=c(Cl-)>c(H+)=c(OH-) | |
| B. | 0.1 mol/L Na2S溶液:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| C. | 25℃时,pH=2的HCOOH与pH=12的NaOH等体积混合:c(HCOO-)<c(Na+) | |
| D. | 0.1 mol/L Na2CO3溶液与0.1 mol/L NaHCO3溶液等体积混合:3c(CO32-)+3c(HCO3-)+3c(H2CO3)=2c(Na+) |
6.醋酸溶液中存在电离平衡CH3COOH?H++CH3COO-,下列叙述正确的是( )
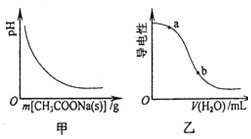

| A. | 图甲表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化 | |
| B. | 图乙表示向CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b | |
| C. | 醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-) | |
| D. | 0.10 mol•L-1的CH3COOH溶液中加水稀释,溶液中c(OH-)减小 |
3.下列离子方程式书写完全正确的是( )
| A. | 用氯化铁溶液腐蚀铜板:Fe3++Cu=Fe2++Cu2+ | |
| B. | NaHSO4溶液与Ba(OH)2溶液混合至溶液显中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| C. | 在碳酸氢镁溶液中加入过量氢氧化钠溶液:Mg2++2HCO3-+4OH-=Mg(OH)2↓+2H2O+2CO32- | |
| D. | 向稀醋酸中加入石灰石:CaCO3+2H+=Ca2++CO2↑+H2O |
7.在某温度下,将2molA和3molB充入一密闭容器中,发生反应:aA(g)+B(g)?C(g)+D(g),5min后达到平衡,测得K=1.若在温度不变的情况下将容器的体积扩大为原来的1倍,测得A的转化率不发生变化,下列说法正确的是( )
| A. | 改变条件前后,B的转化率均为40% | |
| B. | 改变条件前后,C的反应速率保持不变 | |
| C. | 若保持温度和体积不变,在容器中再充入1molA和1molB,B的转化率不变 | |
| D. | 若保持温度和体积不变,在容器中再充入0.5molB、1molC和1molD,B的转化率增大 |
10.常温下,根据表中的几种物质的电离平衡常数回答下列问题:
(1)常温下,等浓度的NH4NO3和NH4NO2两份溶液,测得NH4NO2溶液中c(NH4+)较小,试分析原因:NO2-水解显碱性,对铵根离子水解起到促进作用.0.1mol•L-1NH4NO2溶液中离子浓度由大到小的顺序是c(NO2-)>c(NH4+)>c(H+)>c(OH-),NO2-水解反应的平衡常数Kh=1.4×10-11 mol•L-1(保留两位有效数字).
(2)常温下,用氨水吸收CO2得到NH4HCO3溶液,其pH>7 (填“>”、“<”或“=”);反应NH3•H2O+H2CO3?NH4++HCO3-+H2O的平衡常数K=800.
(3)少量CO2通入到过量的NaClO溶液中发生反应的离子方程式ClO-+CO2+H2O═HCO3-+HClO:
| NH3•H2O | 2×10-5 |
| HNO2 | 7×10-4 |
| HClO | 3×10-8 |
| H2CO3 | K1=4×10-7 K2=4×10-11 |
(2)常温下,用氨水吸收CO2得到NH4HCO3溶液,其pH>7 (填“>”、“<”或“=”);反应NH3•H2O+H2CO3?NH4++HCO3-+H2O的平衡常数K=800.
(3)少量CO2通入到过量的NaClO溶液中发生反应的离子方程式ClO-+CO2+H2O═HCO3-+HClO: