题目内容
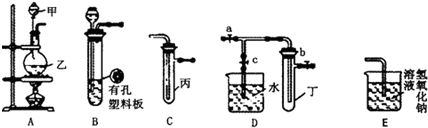
11.用下列实验装置完成对应的实验,不能达到实验目的是( )| A. | 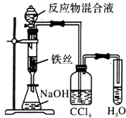 制备少量溴苯 | B. | 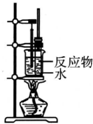 苯的硝化 | ||
| C. |  制备少量乙酸乙酯 | D. | 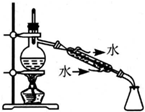 石油的分馏 |
分析 A.苯和溴单质反应生成溴苯;
B.苯的硝化需要用水浴加热;
C.容易造成倒吸;
D.冷凝水下进上出.
解答 解:A.苯和溴单质反应生成溴苯,溴和苯易挥发,需要冷凝回流,故A正确;
B.苯的硝化需要用水浴加热,方便控制温度,故B正确;
C.导管伸入饱和碳酸钠溶液中,容易造成倒吸,故C错误;
D.冷凝水下进上出,温度计水银球与蒸馏烧瓶支管口处相平,故D正确.
故选C.
点评 本题考查较为综合,涉及基础实验操作,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握实验的方法、步骤和使用的仪器,注重相关基础知识的积累,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.将一定量的氯气通入30mL浓度为10.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成氯化钠、次氯酸钠、氯酸钠共存体系.下列判断正确的是( )
| A. | 与氢氧化钠反应的氯气一定为0.16 mol | |
| B. | n(Na+):n(Cl-)可能为7:3 | |
| C. | 若反应中转移的电子为n mol,则0.15<n<0.25 | |
| D. | n(NaCl):n(NaClO):n(NaClO3)可能为11:2:1 |
2.向20mL1mol/L的Al2(SO4)3溶液中加入30mLKOH溶液充分反应后得到0.78g沉淀,则KOH溶液的物质的量浓度为( )
| A. | 1mol/L或5mol/L | B. | 3mol/L或5mol/L | C. | 1mol/L或3mol/L | D. | 3mol/L或7mol/L |
19.设NA为阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 4 g重水中所含质子数为2NA | |
| B. | 在H2O2+Cl2═2HCl+O2反应中,每生成32g氧气,则转移2NA个电子 | |
| C. | 铜与足量浓硫酸共热放出4.48 LSO2时,消耗的铜原子数为0.2NA | |
| D. | 8.0 gCu2S和CuO的混合物中含有铜原子数为0.1NA |
6.下列各项所述的两个量,前者一定大于(或高于)后者的是( )
| A. | F2和Br2的沸点 | |
| B. | H-和Be2+的离子半径 | |
| C. | 同温下分别在100g水中最多能溶解的无水CuSO4的质量和CuSO4•5H2O的质量 | |
| D. | 在NH3+NO→N2+H2O反应中,被氧化和被还原的N原子数 |
16.能源和气候问题越来越受到人们的关注,研发和推广太阳能电池是解决能源和气候问题的重要途径.硅是太阳能电池的重要材料,工业制取纯硅,主要涉及以下两个反应:
①Si(s)+3HCl(g)$\frac{\underline{\;一定条件\;}}{\;}$SiHCl3(g)+H2(g)
②SiHCl3(g)+H2(g)$\frac{\underline{\;一定条件\;}}{\;}$Si(s)+3HCl(g)
对上述反应下列说法中不正确的是( )
①Si(s)+3HCl(g)$\frac{\underline{\;一定条件\;}}{\;}$SiHCl3(g)+H2(g)
②SiHCl3(g)+H2(g)$\frac{\underline{\;一定条件\;}}{\;}$Si(s)+3HCl(g)
对上述反应下列说法中不正确的是( )
| A. | 制备的晶体硅可用于制作计算机芯片 | |
| B. | 该法制备高纯硅,可以综合利用氯气和氢气,使原料循环利用,生产成本低,效率高 | |
| C. | 该过程是把硅转化为SiHCl3与杂质分离,而后用氢气还原得到高纯硅 | |
| D. | 整个制备过程中若混有氧气可以不除去 |
3.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1 mol熔融的KHSO4中含有2 NA个阳离子 | |
| B. | 1 L 0.1 mol/LCH3COONa溶液中,阴离子总数小于0.1 NA | |
| C. | 标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1NA | |
| D. | 与常温常压下17g H2O2所含非极性键数目相同的N2H4的分子总数为0.5NA |
20.一定条件下苯可被臭氧氧化,发生如下化学反应:则二甲苯通过上述反应得到的产物有( )种.


| A. | 2 | B. | 3 | C. | 4 | D. | 5 |