题目内容
19.设NA为阿伏加德罗常数的值,下列说法不正确的是( )| A. | 4 g重水中所含质子数为2NA | |
| B. | 在H2O2+Cl2═2HCl+O2反应中,每生成32g氧气,则转移2NA个电子 | |
| C. | 铜与足量浓硫酸共热放出4.48 LSO2时,消耗的铜原子数为0.2NA | |
| D. | 8.0 gCu2S和CuO的混合物中含有铜原子数为0.1NA |
分析 A、重水的摩尔质量为20g/mol;
B、在H2O2+Cl2═2HCl+O2反应中转移2mol电子;
C、二氧化硫所处的状态不明确;
D、Cu2S的摩尔质量是CuO的2倍,含有的铜原子的个数也是CuO的2倍.
解答 解:A、重水的摩尔质量为20g/mol,故4g重水的物质的量为0.2mol,则含2NA个质子,故A正确;
B、在H2O2+Cl2═2HCl+O2反应中转移2mol电子,生成1mol氧气,故当生成32g氧气即1mol氧气时,转移2NA个电子,故B正确;
C、二氧化硫所处的状态不明确,故不能计算其物质的量和消耗的铜原子个数,故C错误;
D、Cu2S的摩尔质量是CuO的2倍,含有的铜原子的个数也是CuO的2倍,故Cu2S和CuO的混合物可以看做是由“CuO”构成的,则8.0g混合物中含有的CuO的物质的量为0.1mol,则含铜原子为0.1NA个,故D正确.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
9.根据如表(部分短周期元素的原子半径及主要化合价)信息,下列叙述正确的是( )
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.186 | 0.143 | 0.089 | 0.104 | 0.074 |
| 主要化合价 | +1 | +3 | +2 | +6、-2 | -2 |
| A. | B元素不能形成共价化合物 | |
| B. | 离子半径大小A+>D2- | |
| C. | A和E形成的化合物中只可能含离子键 | |
| D. | B和E的化合物不能溶于氨水 |
14.短周期元素W、X、Y、Z 原子序数依次增大,W与Y最外层电子数之和为X的最外层电子数的2倍,Z最外层电子数等于最内层电子数,X、Y、Z的简单离子的电子层结构相同,W的单质是空气中体积分数最大的气体.下列说法正确的是( )
| A. | Y的最高价氧化物对应水化物的酸性比W的强 | |
| B. | W的气态氢化物比X的稳定 | |
| C. | 离子半径的大小顺序:r(W)>r(X)>r(Y)>r(Z) | |
| D. | WX2与ZY2中的化学键类型相同 |
11.用下列实验装置完成对应的实验,不能达到实验目的是( )
| A. | 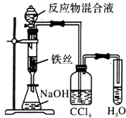 制备少量溴苯 | B. | 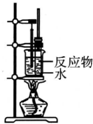 苯的硝化 | ||
| C. | 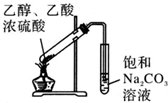 制备少量乙酸乙酯 | D. | 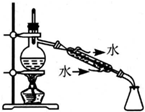 石油的分馏 |
9.W、X、Y、Z为原子序数依次增大的短周期主族元素,它们的最外层电子数总和为12,W属于非金属元素且与X同主族,X+、Y3+均与氖原子电子层结构相同.下列说法正确的是( )
| A. | 单质的还原性:W>X>Y | |
| B. | 原子半径:X>Y>Z>W | |
| C. | X的最高价氧化物对应水化物的碱性比Y的弱 | |
| D. | 化合物XYW4具有强氧化性 |
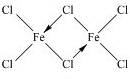 ,你认为该分子是否为平面形分子?否(填“是”或“否”).
,你认为该分子是否为平面形分子?否(填“是”或“否”).