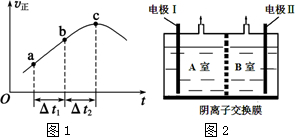
题目内容
2.向20mL1mol/L的Al2(SO4)3溶液中加入30mLKOH溶液充分反应后得到0.78g沉淀,则KOH溶液的物质的量浓度为( )| A. | 1mol/L或5mol/L | B. | 3mol/L或5mol/L | C. | 1mol/L或3mol/L | D. | 3mol/L或7mol/L |
分析 根据Al2(SO4)3溶液与KOH溶液的反应计算分析,20mL1mol/LAl2(SO4)3全转化为沉淀的质量为:0.02L×2mol/L×78g/mol=3.12g,根据Al3++3OH-=Al(OH)3↓和Al(OH)3+OH-=AlO2-+H2O,可知KOH存在两种情况,一是不足,二是使Al(OH)3部分溶解,以此进行计算.
解答 解:20mL1mol/LAl2(SO4)3完全转化为沉淀的质量为:0.02L×2mol/L×78g/mol=3.12g,
根据Al3++3OH-=Al(OH)3↓和Al(OH)3+OH-=AlO2-+H2O,可知存在两种情况,一是不足,二是使Al(OH)3部分溶解,
设KOH的浓度为c,当KOH不足时,
Al3++3OH-=Al(OH)3↓
3mol 78g
0.03L×c 0.78g
则:c=$\frac{3mol×0.78g}{0.03L×78g}$=1mol/L,
当KOH使Al(OH)3部分溶解时,设KOH的物质的量为x,根据反应:
Al3++3OH-=Al(OH)3↓
1mol 3mol 78g
0.04mol 0.12mol 3.12g
Al(OH)3+OH-=AlO2-+H2O
78g 1mol
(3.12-0.78)g (x-0.12mol)
x=0.15mol,
则KOH的物质的量浓度为:c=$\frac{n}{V}$=$\frac{0.15mol}{0.03L}$=5mol/L,
由上述分析计算可知,KOH溶液的物质的量浓度为1mol/L或5mol/L,
故选A.
点评 本题考查物质的量浓度的计算,题目难度中等,明确反应后产物组成为解答关键,注意掌握讨论法在化学计算中的应用,试题培养了学生的化学计算能力.

 学业测评一课一测系列答案
学业测评一课一测系列答案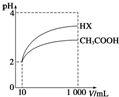 25℃时,部分物质的电离平衡常数如表所示:
25℃时,部分物质的电离平衡常数如表所示:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为CH3COOH>H2CO3>HClO.
(2)同浓度的CH3COO-、HCO${\;}_{3}^{-}$、CO${\;}_{3}^{2-}$、ClO-结合H+的能力由强到弱的顺序为CO32->ClO->HCO3->CH3COO-.
(3)物质的量浓度均为0.1mol•L-1的下列四种物质的溶液:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3,pH由大到小的顺序是a>b>d>c(填编号).
(4)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是稀释相同倍数,HX的pH变化比CH3COOH的大,酸性强,电离平衡常数大,稀释后,HX溶液中由水电离出来的c(H+)大于(填“大于”、“等于”或“小于”)醋酸溶液中由水电离出来的c(H+
),理由是HX酸性强于CH3COOH的,稀释后HX溶液中的c(H+)小于CH3COOH溶液中的c(H+),所以其对水电离的抑制能力也较弱.
| A. | Al2O3和NaOH溶液反应:Al2O3+2OH-═2AlO2-+H2↑ | |
| B. | NaHCO3溶液与NaOH溶液反应:OH-+HCO3-═CO2↑+H2O | |
| C. | Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| D. | AlCl3溶液中加入足量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
| A. | Y的最高价氧化物对应水化物的酸性比W的强 | |
| B. | W的气态氢化物比X的稳定 | |
| C. | 离子半径的大小顺序:r(W)>r(X)>r(Y)>r(Z) | |
| D. | WX2与ZY2中的化学键类型相同 |
| A. | 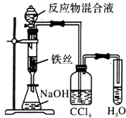 制备少量溴苯 | B. | 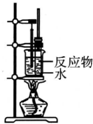 苯的硝化 | ||
| C. | 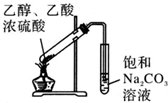 制备少量乙酸乙酯 | D. | 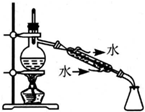 石油的分馏 |
A.苹果中的Fe2+被空气中的氧气氧化成了Fe3+
B.苹果中的酚类物质被空气中的氧气氧化了
究竟哪种说法正确,某小组同学通过实验进行了探究.
实验用品:苹果、浓度均为0.1mol•L-1的盐酸、NaHCO3溶液、Na2SO3溶液,KSCN溶液,去氧蒸馏水.
(1)探究1:
| 实验操作 | 实验现象 | 结论 |
| 在“褐变”后的苹果上滴上2~3滴 KSCN溶液. | 无红色出现 | 说法A不正确 |
【查阅文献】
苹果中含有多种酚和酚氧化酶,苹果中酚氧化酶的活性温度为35℃左右、活性pH约为5.5-7.5.
Ⅱ.酚类物质遇FeCl3溶液常发生显色反应而呈现一定颜色,如苯酚显紫色,对苯二酚显绿色,甲基苯酚显蓝色.
该小组将刚削皮的苹果切成七块,分别进行如下实验.请填写下表中相应的结论:
| 序号 | 实验步骤 | 现 象 | 结 论 |
| ① | 在一块上滴加2~3滴FeCl3溶液 | 表面变为绿色 | 对苯二酚 |
| ② | 再取两块,一块放置于空气中,另一块迅速浸入经过去氧的蒸馏水中. | 前者表面逐渐褐变,后者相当长一段时间内,无明显变化. | 苹果褐变与氧气有关 |
| ③ | 另两块分别立刻放入沸水和0.1mol•L-1盐酸中浸泡2min后取出,置于空气中. | 相当长一段时间内,两块均无明显变化. | 苹果褐变与酚氧化酶的活性有关 |
| ④ | 最后两块分别立刻放入浓度均为0.1mol•L-1的NaHCO3和Na2SO3溶液里浸泡2min后取出,置于空气中. | 前者经过一段时间表面逐渐褐变,后者相当长一段时间内,无明显变化. | 亚硫酸钠溶液能阻止苹果褐变 |
Ⅰ、常温下,浓度均为0.1mol•L -1 NaHCO3溶液略显碱性,而NaHSO3溶液却略显酸性. NaHSO3溶液略显酸性是因为亚硫酸氢离子电离大于水解.
Ⅱ、0.1mol•L-1的NaHCO3溶液和Na2SO3溶液的pH相近,Na2SO3溶液却能阻止苹果褐变,结合离子方程式分析原因:亚硫酸钠的还原性比酚强,消耗了氧气,保护了酚;2SO32-+O2═2SO42-,
Ⅲ、对探究2中的试验③所得结论作进一步解释酶是蛋白质,在强酸、强碱或加热条件下会变性,失去活性;.