题目内容
3.设NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 1 mol熔融的KHSO4中含有2 NA个阳离子 | |
| B. | 1 L 0.1 mol/LCH3COONa溶液中,阴离子总数小于0.1 NA | |
| C. | 标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1NA | |
| D. | 与常温常压下17g H2O2所含非极性键数目相同的N2H4的分子总数为0.5NA |
分析 A.依据KHSO4(熔融)=K++HSO4-计算;
B.N(CH3COO-)+N(OH-)=N(Na+)+N(H+),N(Na+)=1 L×0.1 mol/L×${{N}_{A}mol}^{-1}$=0.1NA;
C.0.3mol二氧化氮与水反应生成0.2mol硝酸和0.1mol一氧化氮;
D.双氧水分子中含有1个非极性键,17g双氧水的物质的量为0.5mol,含有0.5mol非极性键,N2H4分子中含有1个非极性键,据此计算出需要N2H4的物质的量.
解答 解:A.KHSO4(熔融)=K++HSO4-,1 mol熔融的KHSO4电离产生1molK+,即 NA个阳离子,故A错误;
B.根据电荷守恒C(CH3COO-)+C(OH-)=C(Na+)+C(H+),N(Na+)=1 L×0.1 mol/L×${{N}_{A}mol}^{-1}$=0.1NA,因此阴离子总数为C(CH3COO-)+C(OH-)=C(Na+)+C(H+)>0.1NA,故B错误;
C.标况下,6.72L二氧化氮的物质的量为0.3mol,0.3mol二氧化氮与水反应生成了0.1mol一氧化氮,转移了0.2mol电子,转移的电子数目为0.2NA,故C错误;
D.17g双氧水的物质的量为0.5mol,含有0.5mol非极性键,N2H4分子中含有1个非极性键,需要N2H4的物质的量为0.5mol,N2H4的分子总数为0.5NA,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的计算与判断,题目难度中等,明确标准状况下气体摩尔体积的使用条件为解答关键,注意掌握物质的量与阿伏伽德罗常数、摩尔质量等之间的关系,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
14.短周期元素W、X、Y、Z 原子序数依次增大,W与Y最外层电子数之和为X的最外层电子数的2倍,Z最外层电子数等于最内层电子数,X、Y、Z的简单离子的电子层结构相同,W的单质是空气中体积分数最大的气体.下列说法正确的是( )
| A. | Y的最高价氧化物对应水化物的酸性比W的强 | |
| B. | W的气态氢化物比X的稳定 | |
| C. | 离子半径的大小顺序:r(W)>r(X)>r(Y)>r(Z) | |
| D. | WX2与ZY2中的化学键类型相同 |
11.用下列实验装置完成对应的实验,不能达到实验目的是( )
| A. | 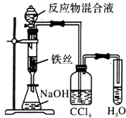 制备少量溴苯 | B. | 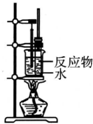 苯的硝化 | ||
| C. | 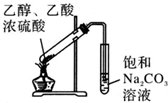 制备少量乙酸乙酯 | D. | 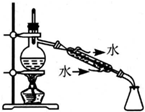 石油的分馏 |
15.下列对某些问题的认识正确的是( )
| A. | 漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的 | |
| B. | 在船底镶嵌锌块和将船体与电源负极相连,二者防腐的方法都称为牺牲阳极的阴极保护法 | |
| C. | 1 mol葡萄糖水解能生成2mol CH3CH2OH和2mol CO2 | |
| D. | 不能用带玻璃塞的玻璃瓶和酸式滴定管盛取碱液,二者的原因是相同的 |
12.新切开的苹果在空气中放置一段时间表面会变黄,最终变成褐色,这种现象在食品科学上通常称为“褐变”. 关于苹果褐变的原因有以下两种说法:
A.苹果中的Fe2+被空气中的氧气氧化成了Fe3+
B.苹果中的酚类物质被空气中的氧气氧化了
究竟哪种说法正确,某小组同学通过实验进行了探究.
实验用品:苹果、浓度均为0.1mol•L-1的盐酸、NaHCO3溶液、Na2SO3溶液,KSCN溶液,去氧蒸馏水.
(1)探究1:
(2)探究2:
【查阅文献】
苹果中含有多种酚和酚氧化酶,苹果中酚氧化酶的活性温度为35℃左右、活性pH约为5.5-7.5.
Ⅱ.酚类物质遇FeCl3溶液常发生显色反应而呈现一定颜色,如苯酚显紫色,对苯二酚显绿色,甲基苯酚显蓝色.
该小组将刚削皮的苹果切成七块,分别进行如下实验.请填写下表中相应的结论:
(3)问题分析:
Ⅰ、常温下,浓度均为0.1mol•L -1 NaHCO3溶液略显碱性,而NaHSO3溶液却略显酸性. NaHSO3溶液略显酸性是因为亚硫酸氢离子电离大于水解.
Ⅱ、0.1mol•L-1的NaHCO3溶液和Na2SO3溶液的pH相近,Na2SO3溶液却能阻止苹果褐变,结合离子方程式分析原因:亚硫酸钠的还原性比酚强,消耗了氧气,保护了酚;2SO32-+O2═2SO42-,
Ⅲ、对探究2中的试验③所得结论作进一步解释酶是蛋白质,在强酸、强碱或加热条件下会变性,失去活性;.
A.苹果中的Fe2+被空气中的氧气氧化成了Fe3+
B.苹果中的酚类物质被空气中的氧气氧化了
究竟哪种说法正确,某小组同学通过实验进行了探究.
实验用品:苹果、浓度均为0.1mol•L-1的盐酸、NaHCO3溶液、Na2SO3溶液,KSCN溶液,去氧蒸馏水.
(1)探究1:
| 实验操作 | 实验现象 | 结论 |
| 在“褐变”后的苹果上滴上2~3滴 KSCN溶液. | 无红色出现 | 说法A不正确 |
【查阅文献】
苹果中含有多种酚和酚氧化酶,苹果中酚氧化酶的活性温度为35℃左右、活性pH约为5.5-7.5.
Ⅱ.酚类物质遇FeCl3溶液常发生显色反应而呈现一定颜色,如苯酚显紫色,对苯二酚显绿色,甲基苯酚显蓝色.
该小组将刚削皮的苹果切成七块,分别进行如下实验.请填写下表中相应的结论:
| 序号 | 实验步骤 | 现 象 | 结 论 |
| ① | 在一块上滴加2~3滴FeCl3溶液 | 表面变为绿色 | 对苯二酚 |
| ② | 再取两块,一块放置于空气中,另一块迅速浸入经过去氧的蒸馏水中. | 前者表面逐渐褐变,后者相当长一段时间内,无明显变化. | 苹果褐变与氧气有关 |
| ③ | 另两块分别立刻放入沸水和0.1mol•L-1盐酸中浸泡2min后取出,置于空气中. | 相当长一段时间内,两块均无明显变化. | 苹果褐变与酚氧化酶的活性有关 |
| ④ | 最后两块分别立刻放入浓度均为0.1mol•L-1的NaHCO3和Na2SO3溶液里浸泡2min后取出,置于空气中. | 前者经过一段时间表面逐渐褐变,后者相当长一段时间内,无明显变化. | 亚硫酸钠溶液能阻止苹果褐变 |
Ⅰ、常温下,浓度均为0.1mol•L -1 NaHCO3溶液略显碱性,而NaHSO3溶液却略显酸性. NaHSO3溶液略显酸性是因为亚硫酸氢离子电离大于水解.
Ⅱ、0.1mol•L-1的NaHCO3溶液和Na2SO3溶液的pH相近,Na2SO3溶液却能阻止苹果褐变,结合离子方程式分析原因:亚硫酸钠的还原性比酚强,消耗了氧气,保护了酚;2SO32-+O2═2SO42-,
Ⅲ、对探究2中的试验③所得结论作进一步解释酶是蛋白质,在强酸、强碱或加热条件下会变性,失去活性;.
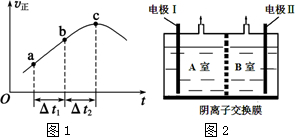
 喷泉是一种常见的自然现象,其产生原因通常是装置内外存在压强差.
喷泉是一种常见的自然现象,其产生原因通常是装置内外存在压强差.
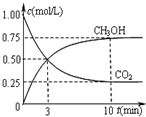 工业上可以以煤和水为原料通过一系列转化变为清洁能源氢气或工业原料甲醇.
工业上可以以煤和水为原料通过一系列转化变为清洁能源氢气或工业原料甲醇.