题目内容
20.一定条件下苯可被臭氧氧化,发生如下化学反应:则二甲苯通过上述反应得到的产物有( )种.
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
分析 根据题给信息可知,苯被氧化成乙二酸,类比二甲苯也被氧化成乙二酸,甲基的位置和原来在苯环上不变即把甲基当成苯环上氢原子看待.
解答 解:若二甲苯为邻二甲苯,则断键位置可能为从两个甲基相连碳处断开,形成二甲基乙二酸和乙二酸,若在两个甲基中间碳断键,则形成甲基乙二酸和乙二酸,共三种,若为对二甲苯或间二甲苯,则断键得到甲基乙二酸和乙二酸,因此得到的产物最多有3种,故选B.
点评 本题考查了同分异构体的判断,中等难度,正确利用题给信息类比是解题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.用下列实验装置完成对应的实验,不能达到实验目的是( )
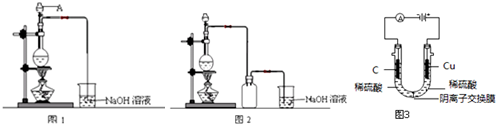
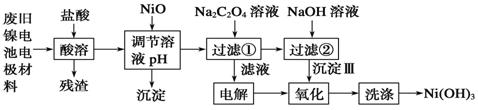
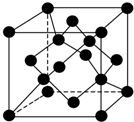
| A. |  制备少量溴苯 | B. |  苯的硝化 | ||
| C. |  制备少量乙酸乙酯 | D. |  石油的分馏 |
15.下列对某些问题的认识正确的是( )
| A. | 漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的 | |
| B. | 在船底镶嵌锌块和将船体与电源负极相连,二者防腐的方法都称为牺牲阳极的阴极保护法 | |
| C. | 1 mol葡萄糖水解能生成2mol CH3CH2OH和2mol CO2 | |
| D. | 不能用带玻璃塞的玻璃瓶和酸式滴定管盛取碱液,二者的原因是相同的 |
12.新切开的苹果在空气中放置一段时间表面会变黄,最终变成褐色,这种现象在食品科学上通常称为“褐变”. 关于苹果褐变的原因有以下两种说法:
A.苹果中的Fe2+被空气中的氧气氧化成了Fe3+
B.苹果中的酚类物质被空气中的氧气氧化了
究竟哪种说法正确,某小组同学通过实验进行了探究.
实验用品:苹果、浓度均为0.1mol•L-1的盐酸、NaHCO3溶液、Na2SO3溶液,KSCN溶液,去氧蒸馏水.
(1)探究1:
(2)探究2:
【查阅文献】
苹果中含有多种酚和酚氧化酶,苹果中酚氧化酶的活性温度为35℃左右、活性pH约为5.5-7.5.
Ⅱ.酚类物质遇FeCl3溶液常发生显色反应而呈现一定颜色,如苯酚显紫色,对苯二酚显绿色,甲基苯酚显蓝色.
该小组将刚削皮的苹果切成七块,分别进行如下实验.请填写下表中相应的结论:
(3)问题分析:
Ⅰ、常温下,浓度均为0.1mol•L -1 NaHCO3溶液略显碱性,而NaHSO3溶液却略显酸性. NaHSO3溶液略显酸性是因为亚硫酸氢离子电离大于水解.
Ⅱ、0.1mol•L-1的NaHCO3溶液和Na2SO3溶液的pH相近,Na2SO3溶液却能阻止苹果褐变,结合离子方程式分析原因:亚硫酸钠的还原性比酚强,消耗了氧气,保护了酚;2SO32-+O2═2SO42-,
Ⅲ、对探究2中的试验③所得结论作进一步解释酶是蛋白质,在强酸、强碱或加热条件下会变性,失去活性;.
A.苹果中的Fe2+被空气中的氧气氧化成了Fe3+
B.苹果中的酚类物质被空气中的氧气氧化了
究竟哪种说法正确,某小组同学通过实验进行了探究.
实验用品:苹果、浓度均为0.1mol•L-1的盐酸、NaHCO3溶液、Na2SO3溶液,KSCN溶液,去氧蒸馏水.
(1)探究1:
| 实验操作 | 实验现象 | 结论 |
| 在“褐变”后的苹果上滴上2~3滴 KSCN溶液. | 无红色出现 | 说法A不正确 |
【查阅文献】
苹果中含有多种酚和酚氧化酶,苹果中酚氧化酶的活性温度为35℃左右、活性pH约为5.5-7.5.
Ⅱ.酚类物质遇FeCl3溶液常发生显色反应而呈现一定颜色,如苯酚显紫色,对苯二酚显绿色,甲基苯酚显蓝色.
该小组将刚削皮的苹果切成七块,分别进行如下实验.请填写下表中相应的结论:
| 序号 | 实验步骤 | 现 象 | 结 论 |
| ① | 在一块上滴加2~3滴FeCl3溶液 | 表面变为绿色 | 对苯二酚 |
| ② | 再取两块,一块放置于空气中,另一块迅速浸入经过去氧的蒸馏水中. | 前者表面逐渐褐变,后者相当长一段时间内,无明显变化. | 苹果褐变与氧气有关 |
| ③ | 另两块分别立刻放入沸水和0.1mol•L-1盐酸中浸泡2min后取出,置于空气中. | 相当长一段时间内,两块均无明显变化. | 苹果褐变与酚氧化酶的活性有关 |
| ④ | 最后两块分别立刻放入浓度均为0.1mol•L-1的NaHCO3和Na2SO3溶液里浸泡2min后取出,置于空气中. | 前者经过一段时间表面逐渐褐变,后者相当长一段时间内,无明显变化. | 亚硫酸钠溶液能阻止苹果褐变 |
Ⅰ、常温下,浓度均为0.1mol•L -1 NaHCO3溶液略显碱性,而NaHSO3溶液却略显酸性. NaHSO3溶液略显酸性是因为亚硫酸氢离子电离大于水解.
Ⅱ、0.1mol•L-1的NaHCO3溶液和Na2SO3溶液的pH相近,Na2SO3溶液却能阻止苹果褐变,结合离子方程式分析原因:亚硫酸钠的还原性比酚强,消耗了氧气,保护了酚;2SO32-+O2═2SO42-,
Ⅲ、对探究2中的试验③所得结论作进一步解释酶是蛋白质,在强酸、强碱或加热条件下会变性,失去活性;.
9.W、X、Y、Z为原子序数依次增大的短周期主族元素,它们的最外层电子数总和为12,W属于非金属元素且与X同主族,X+、Y3+均与氖原子电子层结构相同.下列说法正确的是( )
| A. | 单质的还原性:W>X>Y | |
| B. | 原子半径:X>Y>Z>W | |
| C. | X的最高价氧化物对应水化物的碱性比Y的弱 | |
| D. | 化合物XYW4具有强氧化性 |
 自然界存在丰富的碳、氮、硅、磷、铁等元素,它们可形成单质及许多化合物.按要求回答下列问题:
自然界存在丰富的碳、氮、硅、磷、铁等元素,它们可形成单质及许多化合物.按要求回答下列问题: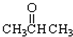 ③CH3CH2Br ④
③CH3CH2Br ④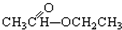 ⑤
⑤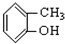 ⑥
⑥ ⑦
⑦ ⑧
⑧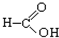 ⑨
⑨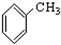 ⑩
⑩