题目内容
16.能源和气候问题越来越受到人们的关注,研发和推广太阳能电池是解决能源和气候问题的重要途径.硅是太阳能电池的重要材料,工业制取纯硅,主要涉及以下两个反应:①Si(s)+3HCl(g)$\frac{\underline{\;一定条件\;}}{\;}$SiHCl3(g)+H2(g)
②SiHCl3(g)+H2(g)$\frac{\underline{\;一定条件\;}}{\;}$Si(s)+3HCl(g)
对上述反应下列说法中不正确的是( )
| A. | 制备的晶体硅可用于制作计算机芯片 | |
| B. | 该法制备高纯硅,可以综合利用氯气和氢气,使原料循环利用,生产成本低,效率高 | |
| C. | 该过程是把硅转化为SiHCl3与杂质分离,而后用氢气还原得到高纯硅 | |
| D. | 整个制备过程中若混有氧气可以不除去 |
分析 A、Si单质为半导体,纯净的硅晶体可用于制作计算机芯片;
B、循环利用提高原料的利用率,降低生产成本;
C、根据反应SiHCl3(g)+H2(g)$\frac{\underline{\;一定条件\;}}{\;}$Si(s)+3HCl(g)分析解答;
D、混有氧气会与过程中产生的氢气混合发生爆炸.
解答 解:A、Si单质为半导体,纯净的硅晶体可用于制作计算机芯片,所以制备的晶体硅可用于制作计算机芯片,故A正确;
B、循环利用提高原料的利用率,降低生产成本,故B正确;
C、根据反应SiHCl3(g)+H2(g)$\frac{\underline{\;一定条件\;}}{\;}$Si(s)+3HCl(g),所以可把硅转化为SiHCl3与杂质分离,而后用氢气还原得到高纯硅,故C正确;
D、混有氧气会与过程中产生的氢气混合发生爆炸,所以整个制备过程中若混有氧气要除去,故D错误;
故选D.
点评 本题考查物质的性质及用途、硅的冶炼方法,难度不大.要注意根据物质的性质分析其用途.

练习册系列答案
 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
11.用下列实验装置完成对应的实验,不能达到实验目的是( )
| A. | 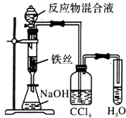 制备少量溴苯 | B. | 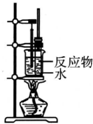 苯的硝化 | ||
| C. | 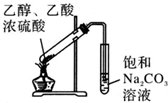 制备少量乙酸乙酯 | D. | 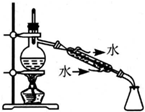 石油的分馏 |
6.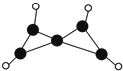 科学家最近在-100℃的低温下合成一种烃X,此分子的结构如图所示(图中的连线表示化学键).下列说法不正确的是( )
科学家最近在-100℃的低温下合成一种烃X,此分子的结构如图所示(图中的连线表示化学键).下列说法不正确的是( )
 科学家最近在-100℃的低温下合成一种烃X,此分子的结构如图所示(图中的连线表示化学键).下列说法不正确的是( )
科学家最近在-100℃的低温下合成一种烃X,此分子的结构如图所示(图中的连线表示化学键).下列说法不正确的是( )| A. | X在常温下不能稳定存在 | |
| B. | X的性质与烯烃类似,容易发生加成反应 | |
| C. | X不能使酸性KMnO4溶液褪色 | |
| D. | 充分燃烧等质量的X和甲烷,X消耗氧气比甲烷少 |
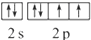 ,该元素的符号是O;
,该元素的符号是O;
 ,你认为该分子是否为平面形分子?否(填“是”或“否”).
,你认为该分子是否为平面形分子?否(填“是”或“否”).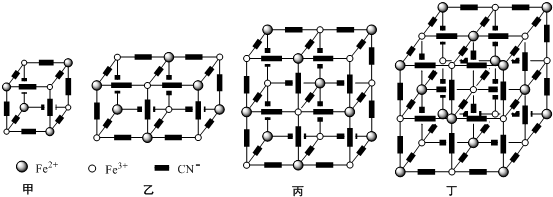

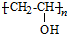 、CH3CH2CH2CHO.
、CH3CH2CH2CHO.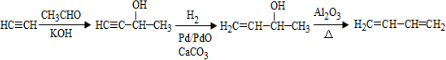 .
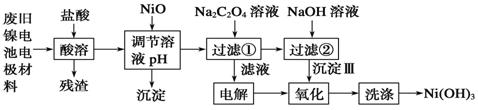
.
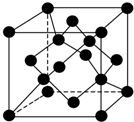 自然界存在丰富的碳、氮、硅、磷、铁等元素,它们可形成单质及许多化合物.按要求回答下列问题:
自然界存在丰富的碳、氮、硅、磷、铁等元素,它们可形成单质及许多化合物.按要求回答下列问题: