题目内容
下列有关NH3的实验正确的是( )
| A | B | C | D |
 |
 |
 |
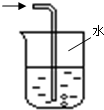 |
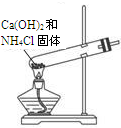
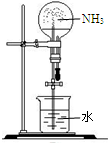
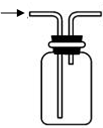
| 实验室制NH3 | 证明NH3极易溶于水 | 收集NH3 | 吸收多余NH3 |
| A、A | B、B | C、C | D、D |
考点:化学实验方案的评价
专题:实验评价题
分析:氨气极易溶于水,密度比空气小,应用向下排空气法收集,实验室常用氯化铵和氢氧化钙在加热条件下制备氨气,吸收氨气时,注意防止倒吸现象,以此解答该题.
解答:
解:A.试管口应略向下倾斜,易防止试管炸裂,故A错误;
B.氨气易溶于水,可形成喷泉,故B正确;
C.氨气密度比空气小,应用向下排空气法收集,气体应从短管进,从长管出,故C错误;
D.氨气易溶于水,导管不能插入到液面以下,应防止倒吸,故D错误.
故选B.
B.氨气易溶于水,可形成喷泉,故B正确;
C.氨气密度比空气小,应用向下排空气法收集,气体应从短管进,从长管出,故C错误;
D.氨气易溶于水,导管不能插入到液面以下,应防止倒吸,故D错误.
故选B.
点评:本题综合考查氨气的性质,制备和收集等知识,为高考高频考点,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,难度不大,注意相关基础知识的积累.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案
相关题目
以下物质的提纯方法错误的是(括号内为杂质)( )
| A、CO2(H2S):通过CuSO4溶液 |
| B、CH3COOH(H2O):加新制生石灰,蒸馏 |
| C、苯(甲苯):加酸性高锰酸钾溶液、再加NaOH溶液,分液 |
| D、MgCl2溶液(Fe3+):加MgO,过滤 |
 25℃时,由弱酸(HA)及其盐(NaA)组成的混合溶液,起始浓度均为1mol?L-1.如图为向该溶液中通入HCl气体或加入NaOH固体时,溶液pH随加入H+或OH-的物质的量而变化的曲线.下列说法中,正确的是( )
25℃时,由弱酸(HA)及其盐(NaA)组成的混合溶液,起始浓度均为1mol?L-1.如图为向该溶液中通入HCl气体或加入NaOH固体时,溶液pH随加入H+或OH-的物质的量而变化的曲线.下列说法中,正确的是( )| A、加NaOH,HA电离平衡常数增大 |
| B、通入HCl,溶液中阴离子浓度之和减小 |
| C、溶液中水的电离程度a>b>c |
| D、b点溶液中,c(HA)<c(A-) |
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混台后所得溶液的pH如下表:
下列判断不正确的是( )
| 实验编号 | HA物质的量浓度(mol?L-1) | NaOH物质的量浓度(mol?L-1) | 混合溶液的pH |
| ①②③ | 0.1 | 0.1 | pH=9 |
| C | 0.2 | pH=7 | |
| 0.2 | 0.1 | pH<7 |
| A、HA的电离方程式为:HA?H++A- |
| B、不考虑其他组的实验结果,c≥0.2 |
| C、③组实验中,混合溶液中c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-) |
| D、①组实验中,混合溶液中c(A-)=(0.1+10-9-10-5)mol/L |
下列比较中,正确的是( )
| A、CH4与SiH4的稳定性:CH4>SiH4 |
| B、HClO与H2SO4的酸性:HClO>H2SO4 |
| C、1mol HCl(g)的能量比1mol H2(g)和1mol Cl2(g)的能量和高 |
| D、Cl与S的原子半径:Cl>S |
用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、标准状况下,22.4L SO3中含有的氧原子数为3NA |
| B、标准状况下,22.4L Cl2与足量的稀NaOH 溶液反应,转移电子总数为2NA |
| C、1mol N5+共有34NA核外电子 |
| D、0.5mol CCl4中含有共价键数目为4NA |
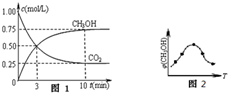 火力发电厂释放出大量氮氧化物(NOx)、SO2和CO2等气体会造成环境问题.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的.
火力发电厂释放出大量氮氧化物(NOx)、SO2和CO2等气体会造成环境问题.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的.