题目内容
5.已知反应:KBrO3+AsH3+H2SO4--H3AsO4+K2SO4+H2O+Br2(未配平).下列叙述不正确的是( )| A. | 反应中KBrO3得电子作氧化剂 | |
| B. | 氧化剂和还原剂的物质的量比为5:8 | |
| C. | 根据上述反应可推知,还原性:AsH3>Br2 | |
| D. | 0.2 mol KBrO3参加反应电子转移1 mol |
分析 Br元素的化合价降低,As元素的化合价升高,根据原子守恒和得失电子守恒可知,8KBrO3+4H2SO4+5AsH3=5H3AsO4+4K2SO4+4H2O+4Br2,结合氧化还原反应中基本概念及转移电子解答.
解答 解:反应的方程式应为8KBrO3+4H2SO4+5AsH3=5H3AsO4+4K2SO4+4H2O+4Br2,
A.Br元素的化合价降低,反应中KBrO3得电子作氧化剂,故A正确;
B.KBrO3得电子作氧化剂,反应中AsH3为还原剂,氧化剂和还原剂的物质的量比为8:5,故B错误;
C.反应中AsH3为还原剂,Br2为还原产物,则还原性AsH3>Br2,故C正确;
D.0.2mol KBrO3在反应中得到1mol电子,故D正确.
故选B.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,注意从电子守恒及化合价角度分析,题目难度不大.

练习册系列答案
相关题目
8.分子中碳与氢两元素的质量比为24:5的烃的一氯代物共有( )
| A. | 4种 | B. | 3种 | C. | 6种 | D. | 5种 |
16.在同温同压下,相同体积的氢气和氦气具有相同的( )
| A. | 原子数 | B. | 质量 | C. | 中子数 | D. | 质子数 |
13.已知:2Fe2++Br2═2Fe3++2Br-,2Fe3++2I-═2Fe2++I2.向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.下列有关说法中,不正确的是( )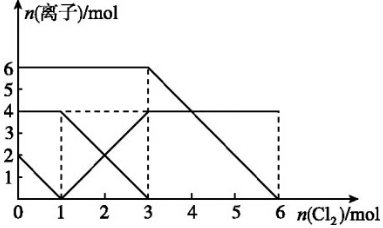

| A. | 还原性:I->Fe2+>Br- | |
| B. | 原混合溶液中FeBr2的物质的量为3 mol | |
| C. | 当通入1mol Cl2时,溶液中已发生的反应为2Fe2++Cl2═2Fe3++2Cl- | |
| D. | 原溶液中n(Fe2+):n(I-):n(Br-)=2:1:3 |
20.下列有关说法正确的是( )
| A. | 根据HA、HB的电离常数的相对大小可以直接判断两种溶液的酸性强弱 | |
| B. | 常温下2S2O(g)=3S(s)+SO2(g)能自发进行,可推断该反应为放热反应 | |
| C. | 加入硫酸铜可使锌与稀硫酸的反应速率加快,说明Cu2+具有催化作用 | |
| D. | 将浓硫酸和浓硝酸混合后立即放入铁片,铁片被钝化的效果一定会更好 |
10.在氯化铁和氯化铜和盐酸的混合溶液中加入铁粉,待反应结束后,将剩余的固体滤出,发现固体哪呢过被磁铁吸引,则反应后溶液中大量存在的阳离子是( )
| A. | Cu2+ Fe2+ | B. | H+ | C. | Cu2+ Fe3+ | D. | Fe2+ |
17.25℃时,向纯水中加入NaOH,使溶液的pH为11,则由NaOH电离出的OH-离子浓度为( )mol•L-1.
| A. | 10-3 | B. | 10-11 | C. | 10-14 | D. | 无法确定 |
14.某学生课外兴趣小组为了测定镁铝合金中铝的含量,进行了如下实验.将合金3.0克投入到足量的100mL 1.5mol•L-1的烧碱溶液中,充分反应后分离出未反应的镁,然后在溶液中滴加1.0mol•L-1的盐酸,加入盐酸的体积与得到沉淀的数据如表:
(1)开始沉淀时加入的盐酸体积必须大于70 mL;若得到沉淀的量最大时,加入的盐酸体积为150mL.
(2)合金中铝的质量分数为72%.
| 实验次数 | 加入盐酸的体积 | 沉淀质量 |
| 1 | 60mL | 0 |
| 2 | 80mL | 0.78g |
| 3 | 180mL | 5.46g |
(2)合金中铝的质量分数为72%.
15.下列有机化学方程式书写正确的是( )
| A. | CH4+Cl$\stackrel{光照}{→}$CH2Cl2+H2 | |
| B. | H2C=CH2+Br2→CH3CHBr2 | |
| C. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| D. | CH3COOCH2CH3$→_{△}^{稀硫酸}$CH3COOH+CH3CH2OH |