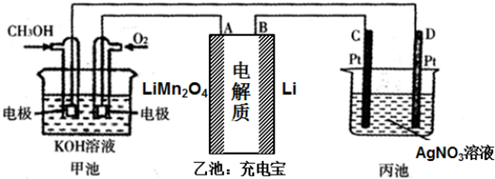
题目内容
17.25℃时,向纯水中加入NaOH,使溶液的pH为11,则由NaOH电离出的OH-离子浓度为( )mol•L-1.| A. | 10-3 | B. | 10-11 | C. | 10-14 | D. | 无法确定 |
分析 25℃时,向纯水中加入NaOH,使溶液的pH为11,该溶液中c(H+)=10-11 mol/L,由NaOH电离出的OH-离子浓度=$\frac{{K}_{w}}{c({H}^{+})}$.
解答 解:25℃时,向纯水中加入NaOH,使溶液的pH为11,该溶液中c(H+)=10-11 mol/L,由NaOH电离出的OH-离子浓度=$\frac{{K}_{w}}{c({H}^{+})}$=$\frac{1{0}^{-14}}{1{0}^{-11}}$mol/L=10-3mol/L,故选A.
点评 本题考查pH的有关计算,为高频考点,明确各个物理量的关系是解本题关键,注意碱中碱电离出c(OH-)与水电离出的c(OH-)关系,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.下列说法正确的是( )
| A. | 常温下,pH=11的NaOH和pH=11的KCN溶液中,水的电离程度相等 | |
| B. | 常温下,往Fe(OH)3悬浊液中分别加入少量NaClO、NH4Cl溶液,的溶解度都增大 | |
| C. | NH4Fe(SO4)2溶液中离子浓度关系:2c(SO42-)+c(OH-)=c(NH4+)+3c(Fe3+)+c(H+) | |
| D. | 10mL0.1mol•L-1CHCOONa溶液与6mL0.2mol•L-1盐酸混合后:c(Cl-)>c(Na+)>c(OH-)>c(H+) |
8.向含有1mol KAl(SO4)2的溶液中加入适量的Ba(OH)2溶液,使SO42-恰好转化为沉淀,此时生成的Al(OH)3的物质的量是( )
| A. | 1mol | B. | 1.33mol | C. | 0.667mol | D. | 0mol |
5.已知反应:KBrO3+AsH3+H2SO4--H3AsO4+K2SO4+H2O+Br2(未配平).下列叙述不正确的是( )
| A. | 反应中KBrO3得电子作氧化剂 | |
| B. | 氧化剂和还原剂的物质的量比为5:8 | |
| C. | 根据上述反应可推知,还原性:AsH3>Br2 | |
| D. | 0.2 mol KBrO3参加反应电子转移1 mol |
9.已知CaSO4受热分解,由于受热温度不同,气体成分也不同.气体成分可能为SO2、SO3和O2中的一种、二种或三种.某化学课外活动小组准备通过系列实验探究CaSO4分解生成的气体,进而确定CaSO4分解的化学方程式.
[提出猜想]
Ⅰ.所得气体的成分可能只含 SO3一种;
Ⅱ.所得气体的成分可能含有SO2、O2 二种;(填分子式)
Ⅲ.所得气体的成分可能含有 SO2、SO3、O2三种.
[设计实验]
该化学课外活动小组准备通过测定D装置的增重以及量筒中水的体积,来探究CaSO4分解生成的气体成分,进而确定CaSO4分解的化学方程式.
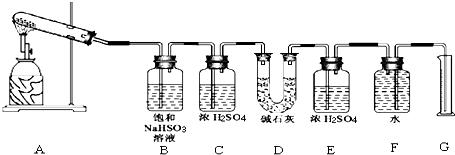
[实验过程]
根据上述实验方案进行试验.已知实验结束时,CaSO4完全分解.
请结合以下实验现象和记录的实验数据进行分析:
(1)若实验结束时,G中量筒没有收集到水,则证明猜想Ⅰ 正确.(填Ⅰ或Ⅱ或Ⅲ)
(2)若实验结束时,装置D的总质量增加,能否断定气体产物中一定含有SO2而不含SO3?请说明理由:不能,因为SO3与B中的饱和NaHSO3反应会生成等物质的量的SO2.
(3)该实验设计中,容易给测定带来较大误差的因素有排水量气法测定气体的体积时量筒和广口瓶中液面变化和压强变化对液体体积的读数会产生误差.
(写出一种即可)
(4)经改进后,有两组同学进行该实验,由于加热时的温度不同,实验测得数据也不同,
相关数据如下:
请通过计算,推断第二组同学得出的CaSO4分解的化学反应方程式:
第二组:2CaSO4$\frac{\underline{\;\;△\;\;}}{\;}$2CaO+2SO2↑+O2↑.
[提出猜想]
Ⅰ.所得气体的成分可能只含 SO3一种;
Ⅱ.所得气体的成分可能含有SO2、O2 二种;(填分子式)
Ⅲ.所得气体的成分可能含有 SO2、SO3、O2三种.
[设计实验]
该化学课外活动小组准备通过测定D装置的增重以及量筒中水的体积,来探究CaSO4分解生成的气体成分,进而确定CaSO4分解的化学方程式.

[实验过程]
根据上述实验方案进行试验.已知实验结束时,CaSO4完全分解.
请结合以下实验现象和记录的实验数据进行分析:
(1)若实验结束时,G中量筒没有收集到水,则证明猜想Ⅰ 正确.(填Ⅰ或Ⅱ或Ⅲ)
(2)若实验结束时,装置D的总质量增加,能否断定气体产物中一定含有SO2而不含SO3?请说明理由:不能,因为SO3与B中的饱和NaHSO3反应会生成等物质的量的SO2.
(3)该实验设计中,容易给测定带来较大误差的因素有排水量气法测定气体的体积时量筒和广口瓶中液面变化和压强变化对液体体积的读数会产生误差.
(写出一种即可)
(4)经改进后,有两组同学进行该实验,由于加热时的温度不同,实验测得数据也不同,
相关数据如下:
| 实验小组 | 称取CaSO4 的质量(g) | 装置D增加 的质量(g) | 量取气体体积的装置测量的气体体积 (折算成标准状况下气体的体积) (mL) |
| 一 | 4.08 | 2.56 | 224 |
| 二 | 5.44 | 2.56 | 448 |
第二组:2CaSO4$\frac{\underline{\;\;△\;\;}}{\;}$2CaO+2SO2↑+O2↑.
6. 某浓差电池的原理示意如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能.下列有关该电池的说法正确的是( )
某浓差电池的原理示意如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能.下列有关该电池的说法正确的是( )
 某浓差电池的原理示意如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能.下列有关该电池的说法正确的是( )
某浓差电池的原理示意如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能.下列有关该电池的说法正确的是( )| A. | 电子由X极通过外电路移向Y极 | |
| B. | 电池工作时,Li+通过离子导体移向b区 | |
| C. | 负极发生的反应为:2H++2e-═H2↑ | |
| D. | Y极每生成1 mol Cl2,a区得到2 mol LiCl |
7.适度饮水有益于健康,但过量饮水使体内电解质浓度过低,导致生理紊乱而引起“水中毒”,下列属于人体内常见电解质的是( )
| A. | CO2 | B. | NaCl | C. | BaSO4 | D. | 葡萄糖 |