题目内容
10.在氯化铁和氯化铜和盐酸的混合溶液中加入铁粉,待反应结束后,将剩余的固体滤出,发现固体哪呢过被磁铁吸引,则反应后溶液中大量存在的阳离子是( )| A. | Cu2+ Fe2+ | B. | H+ | C. | Cu2+ Fe3+ | D. | Fe2+ |
分析 根据金属铁能和三价铁、铜离子以及氢离子反应的性质来分析.
解答 解:充分反应后,所剩余的固体滤出后能被磁铁吸引,则铁粉有剩余,因为三价铁离子会和铁单质生成二价铁离子,所以一定没有三价铁离子,B错误,
铜离子会和单质铁发生置换反应二价铁离子和单质铜,盐酸中的氢离子会和铁单质发生置换反应生成氢气和二价铁离子,所以溶液中一定不含有铜离子、氢离子,A、D错误,所以一定存在的是Fe2+;
故选:D.
点评 本题主要考查学生有关金属铁的性质,可以Fe与三价铁离子、铜离子、氢离子之间的反应来回答,难度不大.

练习册系列答案
相关题目
1.下列反应不属于氧化还原反应的是( )
| A. | 2H2O2═2H2O+O2↑ | B. | HCl+NaOH═H2O+NaCl | ||
| C. | Fe+CuCl2═FeCl2+Cu | D. | 2Cu+O2═2CuO |
18.从柑橘中可提炼出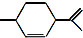 下列关于它的说法不正确的是( )
下列关于它的说法不正确的是( )
 下列关于它的说法不正确的是( )
下列关于它的说法不正确的是( )| A. | 分子式为C10H16 | B. | 其一氯代物有8种 | ||
| C. | 能与溴水发生加成反应 | D. | 常温下呈液态,难溶于水 |
5.已知反应:KBrO3+AsH3+H2SO4--H3AsO4+K2SO4+H2O+Br2(未配平).下列叙述不正确的是( )
| A. | 反应中KBrO3得电子作氧化剂 | |
| B. | 氧化剂和还原剂的物质的量比为5:8 | |
| C. | 根据上述反应可推知,还原性:AsH3>Br2 | |
| D. | 0.2 mol KBrO3参加反应电子转移1 mol |
15.根据如表(部分短周期元素的原子半径及主要化合价)信息,下列叙述正确的是( )
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.186 | 0.143 | 0.089 | 0.104 | 0.074 |
| 主要化合价 | +1 | +3 | +2 | +6、-2 | -2 |
| A. | E2-与B3+的核外电子数不可能相等 | |
| B. | 离子半径大小A+<E2- | |
| C. | 最高价氧化物对应水化物的碱性A<C | |
| D. | 氢化物的稳定性H2D>H2E |
19.下列有关电解质溶液中粒子浓度关系不正确的是( )
| A. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) | |
| B. | 常温下,将0.1 mol•L-1CH3COOH溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中$\frac{{c({C{H_3}CO{O^-}})}}{{c({C{H_3}COOH})}}$的值增大到原来的10倍 | |
| C. | pH相等的①NH4Cl ②(NH4)2SO4③NH4HSO4溶液中:c(NH4+)大小顺序:①>③>② | |
| D. | 含等物质的量的NaHC2O4和Na2C2O4的溶液:2c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
20.下列反应的离子方程式正确的是( )
| A. | 过氧化钠溶于水:2O22-+2H2O═4OH-+O2↑ | |
| B. | 用小苏打治疗胃酸过多:CO32-+2H+═CO2↑+H2O | |
| C. | 硫酸铜与Ba(OH)2溶液反应:Cu2++2OH-═Cu(OH)2↓ | |
| D. | 碳酸氢钠与少量Ca(OH)2溶液反应:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |
 .
.