题目内容
15.下列有机化学方程式书写正确的是( )| A. | CH4+Cl$\stackrel{光照}{→}$CH2Cl2+H2 | |
| B. | H2C=CH2+Br2→CH3CHBr2 | |
| C. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| D. | CH3COOCH2CH3$→_{△}^{稀硫酸}$CH3COOH+CH3CH2OH |
分析 A.氯气为双原子分子,甲烷和氯气发生取代反应生成氯化氢,不是氢气;
B.乙烯与溴发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷结构简式书写错误;
C.乙醇催化氧化,生成乙醛和水;
D.乙酸乙酯在稀酸作用下和水反应生成乙醇和醋酸.
解答 解:A.甲烷和氯气发生取代反应第一步反应生成一氯甲烷,方程式为CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl,故A错误;
B.乙烯与溴发生加成反应生成1,2-二溴乙烷,方程式:Br2+CH2=CH2→BrCH2CH2Br,故B错误;
C.乙醇中含-OH,能发生催化氧化生成乙醛,其反应方程式为:2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O,故C正确;
D.乙酸乙酯在酸性条件下的水解方程式是:CH3COOC2H5+H2O$→_{△}^{稀硫酸}$CH3COOH+C2H5OH,故D错误;
故选C.
点评 本题以有机物方程式的书写为载体,考查有机物的性质,题目难度不大,注意相关物质官能团的性质.

练习册系列答案
相关题目
5.已知反应:KBrO3+AsH3+H2SO4--H3AsO4+K2SO4+H2O+Br2(未配平).下列叙述不正确的是( )
| A. | 反应中KBrO3得电子作氧化剂 | |
| B. | 氧化剂和还原剂的物质的量比为5:8 | |
| C. | 根据上述反应可推知,还原性:AsH3>Br2 | |
| D. | 0.2 mol KBrO3参加反应电子转移1 mol |
6. 某浓差电池的原理示意如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能.下列有关该电池的说法正确的是( )
某浓差电池的原理示意如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能.下列有关该电池的说法正确的是( )
 某浓差电池的原理示意如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能.下列有关该电池的说法正确的是( )
某浓差电池的原理示意如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能.下列有关该电池的说法正确的是( )| A. | 电子由X极通过外电路移向Y极 | |
| B. | 电池工作时,Li+通过离子导体移向b区 | |
| C. | 负极发生的反应为:2H++2e-═H2↑ | |
| D. | Y极每生成1 mol Cl2,a区得到2 mol LiCl |
10. 实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:
实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:
4NH4++6HCHO═3H++6H2O+(CH2)6N4H+(滴定时,1mol(CH2)6N4H+与 l mol H+相当),然后用NaOH标准溶液滴定反应生成的酸,某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ:称取样品1.500g.
步骤Ⅱ:将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀.
步骤Ⅲ:移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次.
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数偏高(填“偏高”、“偏低”或“无影响”).
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积无影响(填“偏大”、“偏小”或“无影响”).
③滴定时边滴边摇动锥形瓶,眼睛应观察B.
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
④判断滴定终点的现象是溶液由无色变为粉红,且保持半分钟不变色.
⑤如图是某次滴定时的滴定管中的液面,其读数为22.60mL.
(2)滴定结果如下表所示:
若NaOH标准溶液的浓度为0.1050mol•L-1则该样品中氮的质量分数为19.6%.
 实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:
实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO═3H++6H2O+(CH2)6N4H+(滴定时,1mol(CH2)6N4H+与 l mol H+相当),然后用NaOH标准溶液滴定反应生成的酸,某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ:称取样品1.500g.
步骤Ⅱ:将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀.
步骤Ⅲ:移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次.
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数偏高(填“偏高”、“偏低”或“无影响”).
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积无影响(填“偏大”、“偏小”或“无影响”).
③滴定时边滴边摇动锥形瓶,眼睛应观察B.
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
④判断滴定终点的现象是溶液由无色变为粉红,且保持半分钟不变色.
⑤如图是某次滴定时的滴定管中的液面,其读数为22.60mL.
(2)滴定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
20.下列反应的离子方程式正确的是( )
| A. | 过氧化钠溶于水:2O22-+2H2O═4OH-+O2↑ | |
| B. | 用小苏打治疗胃酸过多:CO32-+2H+═CO2↑+H2O | |
| C. | 硫酸铜与Ba(OH)2溶液反应:Cu2++2OH-═Cu(OH)2↓ | |
| D. | 碳酸氢钠与少量Ca(OH)2溶液反应:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |
7.适度饮水有益于健康,但过量饮水使体内电解质浓度过低,导致生理紊乱而引起“水中毒”,下列属于人体内常见电解质的是( )
| A. | CO2 | B. | NaCl | C. | BaSO4 | D. | 葡萄糖 |
4.下列说法正确的是( )
| A. | 按系统命名法,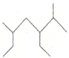 的名称为2-甲基-3,5-二乙基己烷 的名称为2-甲基-3,5-二乙基己烷 | |
| B. | 用Na2C03溶液能区分CH3CO0H、CH3CH2OH、苯和硝基苯四种物质 | |
| C. | 等质量的甲烷、乙烯、1,3一丁二烯分别充分燃烧,所消耗氧气的量依次增加 | |
| D. | 葡萄糖、蔗糖、油脂和蛋白质在一定条件下都能水解 |
5.下列化学物质的用途不正确的是( )
| A. | Na2O常用于潜水艇或呼吸面具的供氧剂 | |
| B. | 氧化镁用作耐火材料 | |
| C. | 利用NaHCO3治疗胃酸过多 | |
| D. | FeCl3溶液可用于刻制印刷铜电路板 |